Омичей заверяют, что этилмеркптан не опасен для здоровья
Содержание:
Химические свойства
Кислотность
Тиолы являются слабыми кислотами, образуя с гидроксидами щелочных и щелочноземельных металлов растворимые в воде тиоляты (меркаптиды), с солями тяжелых металлов — нерастворимые меркаптиды. Являются значительно более сильными кислотами, чем соответствующие кислородные спирты.
|
|
|
|---|---|
|
|
|
|
|
|
|
|
|
|
|
|
|
н-C3H7SH |
|
|
трет-C4H9SH |
|
Тиолят-анионы высоконуклеофильны, и многие реакции замещения водорода группы -SH протекают через промежуточное образование тиолятов.
Так, тиолы алкилируются под действием алкилгалогенидов:
-
- RS−+R1Hal→RSR1+Hal−{\displaystyle {\mathsf {RS^{-}+R^{1}Hal\rightarrow RSR^{1}+Hal^{-}}}}
Тиолы в присутствии оснований (пиридина, третичных аминов) ацилируются с образованием S-ацилпроизводных:
-
- RSH+R1C(O)Hal→R1C(O)SR+HX{\displaystyle {\mathsf {RSH+R^{1}C(O)Hal\rightarrow R^{1}C(O)SR+HX}}}
Нитрозирование тиолов азотистой кислотой или нитрозилхлоридом ведёт к неустойчивым окрашенным нитрозилтиолам (тионитритам):
-
- RSH+HNO2→RSNO+H2O{\displaystyle {\mathsf {RSH+HNO_{2}\rightarrow RSNO+H_{2}O}}}
Эта реакция используется как качественная реакция на тиолы.
Присоединение
Тиолы вступают в реакции присоединения к ацетиленовым, этиленовым и алленовым углеводородам. Реакция может протекать по нуклеофильному, электрофильному либо радикальному механизму.
Окисление
Тиолы окисляются самым широким спектром окислителей (кислород, пероксиды, оксиды азота, галогены и др.). Мягкие окислители (йод, алифатические сульфоксиды, активированный диоксид марганца и т. п.) реагируют с тиолами с образованием дисульфидов:
-
- 2RSH→ORSSR{\displaystyle {\mathsf {2RSH{\xrightarrow{}}RSSR}}}
которые, в свою очередь, при реакции с хлором образуют тиохлориды:
-
- RSSR+Cl2→2RSCl{\displaystyle {\mathsf {RSSR+Cl_{2}\rightarrow 2RSCl}}}
При действии более жёстких окислителей (например, перманганата) сначала образуются сульфиновые кислоты и далее — сульфокислоты:
-
- RSH→ORSO2H→ORSO3H{\displaystyle {\mathsf {RSH{\xrightarrow{}}RSO_{2}H{\xrightarrow{}}RSO_{3}H}}}
В случае окисления тетраацетатом свинца (CH3COO)4Pb в присутствии спиртов окисление идёт с образованием сульфинатов — соответствующих эфиров сульфиновых кислот:
-
- RSH+CH3OH→ORSO2OCH3{\displaystyle {\mathsf {RSH+CH_{3}OH{\xrightarrow{}}RSO_{2}OCH_{3}}}}
В присутствии воды тиолы окисляются хлором до соответствующих сульфонилхлоридов:
-
- RSH→H2O,Cl2RSO2Cl{\displaystyle {\mathsf {RSH{\xrightarrow{H_{2}O,Cl_{2}}}RSO_{2}Cl}}}
Бизнес и финансы
БанкиБогатство и благосостояниеКоррупция(Преступность)МаркетингМенеджментИнвестицииЦенные бумагиУправлениеОткрытые акционерные обществаПроектыДокументыЦенные бумаги — контрольЦенные бумаги — оценкиОблигацииДолгиВалютаНедвижимость(Аренда)ПрофессииРаботаТорговляУслугиФинансыСтрахованиеБюджетФинансовые услугиКредитыКомпанииГосударственные предприятияЭкономикаМакроэкономикаМикроэкономикаНалогиАудитМеталлургияНефтьСельское хозяйствоЭнергетикаАрхитектураИнтерьерПолы и перекрытияПроцесс строительстваСтроительные материалыТеплоизоляцияЭкстерьерОрганизация и управление производством
Справочная информация
ДокументыЗаконыИзвещенияУтверждения документовДоговораЗапросы предложенийТехнические заданияПланы развитияДокументоведениеАналитикаМероприятияКонкурсыИтогиАдминистрации городовПриказыКонтрактыВыполнение работПротоколы рассмотрения заявокАукционыПроектыПротоколыБюджетные организацииМуниципалитетыРайоныОбразованияПрограммыОтчетыпо упоминаниямДокументная базаЦенные бумагиПоложенияФинансовые документыПостановленияРубрикатор по темамФинансыгорода Российской Федерациирегионыпо точным датамРегламентыТерминыНаучная терминологияФинансоваяЭкономическаяВремяДаты2015 год2016 годДокументы в финансовой сферев инвестиционной
Тиильные радикалы
Свободные радикалы, полученные из меркаптанов, называемые тиильными радикалами , обычно используются для объяснения реакций в органической химии и биохимии . Они имеют формулу RS •, где R представляет собой органический заместитель, такой как алкил или арил . Они возникают или могут быть сгенерированы рядом маршрутов, но основным методом является абстрагирование H-атома от тиолов. Другой метод включает гомолиз органических дисульфидов. В биологии тиильные радикалы ответственны за образование дезоксирибонуклеиновых кислот, строительных блоков ДНК . Это превращение катализируется рибонуклеотидредуктазой (см. Рисунок). Промежуточные продукты тиила также образуются при окислении глутатиона , антиоксиданта в биологии. Тиильные радикалы (с центром в сере) могут превращаться в радикалы с центром в углероде через равновесие обмена атомами водорода . Образование углеродных радикалов может привести к повреждению белка из-за образования связей C- C или фрагментации основной цепи.
Из — за слабости SH связи, тиолы могут функционировать в качестве акцепторов от свободных радикалов .
Физические свойства
Запах
Многие тиолы имеют резкий запах, напоминающий запах чеснока . Запах тиолов, особенно низкомолекулярных, часто бывает сильным и отталкивающим. Спрей скунсов состоит в основном из низкомолекулярных тиолов и производных. Эти соединения обнаруживаются человеческим носом в концентрациях всего 10 частей на миллиард. Человеческий пот содержит ( R ) / ( S ) -3-метил-3-меркапто-1-ол (MSH), обнаруживаемый в концентрации 2 частей на миллиард и имеющий фруктовый, похожий на лук запах. (Метилтио) метантиол (MeSCH 2 SH; MTMT) представляет собой летучий тиол с сильным запахом, который также обнаруживается на уровне частей на миллиард, обнаруживаемый в моче самцов мышей . Лоуренс К. Кац и его коллеги показали, что MTMT функционирует как полуохимическое соединение , активируя определенные обонятельные сенсорные нейроны мыши, привлекая самок мышей. Было показано, что медь требуется для специфического обонятельного рецептора мыши, MOR244-3, который очень чувствителен к MTMT, а также к различным другим тиолам и родственным соединениям. Был идентифицирован человеческий обонятельный рецептор OR2T11 , который в присутствии меди очень чувствителен к одорантам газа (см. Ниже) этантиолу и трет- бутилмеркаптану, а также другим тиолам с низкой молекулярной массой, включая аллилмеркаптан, обнаруженный у человека. чесночное дыхание и сильно пахнущий циклический сульфид тиетан .
Тиолы также несут ответственность за класс винных дефектов, вызванных непреднамеренной реакцией между серой и дрожжами, а также «вонючим» запахом пива, подвергшегося воздействию ультрафиолета.
Не все тиолы имеют неприятный запах. Например, фуран-2-илметантиол вносит свой вклад в аромат жареного кофе , тогда как меркаптан грейпфрута , монотерпеноид тиол, отвечает за характерный запах грейпфрута . Эффект последнего соединения присутствует только при низких концентрациях. Чистый меркаптан имеет неприятный запах.
Распределители природного газа были обязаны добавлять тиолы, первоначально этантиол , в природный газ (который, естественно, не имеет запаха) после смертоносного взрыва в Нью-Лондонской школе в Нью-Лондоне, штат Техас , в 1937 году. Многие газораспределители использовали одорированный газ до этого события. Большинство используемых одорантов газа в настоящее время содержат смеси меркаптанов и сульфидов, при этом трет- бутилмеркаптан является основным компонентом запаха в природном газе и этантиолом в сжиженном нефтяном газе (СНГ, пропан). В ситуациях, когда тиолы используются в коммерческой промышленности, например, в танкерах для сжиженного нефтяного газа и в системах обработки сыпучих материалов, для уничтожения запаха используется катализатор окисления. Катализатор окисления на основе меди нейтрализует летучие тиолы и превращает их в инертные продукты.
Точки кипения и растворимость
Тиолы слабо связаны водородными связями как с молекулами воды, так и между собой. Следовательно, они имеют более низкие температуры кипения и менее растворимы в воде и других чем спирты с аналогичной молекулярной массой. По этой же причине тиолы и соответствующие изомеры сульфидных функциональных групп имеют сходные характеристики растворимости и температуры кипения, в то время как то же самое нельзя сказать о спиртах и их соответствующих изомерных простых эфирах.
Склеивание
Связь S-H в тиолах слабая по сравнению со связью O-H в спиртах. Для CH 3 X − H энтальпии связи равны365,07 ± 2,1 ккал / моль для X = S и440,2 ± 3,0 ккал / моль для X = O. Отрыв атома водорода от тиола дает тиильный радикал с формулой RS • , где R = алкил или арил.
3.3 Получение тиоэфиров:

4.
Взаимодействие
алкилгалогенидов с ксантогенатамищелочных
металлов
(Л.А. Чугаев):

5.
Промышленные
методы.
В промышленности
низшие
тиолы получают взаимодействием спиртовсH2S
в присутствии катализаторовпри 300–350 °С. Третичные алкантиолыC8
– C16
– взаимодействием непредельных
углеводородовсH2S
в присутствии А12О3
при 100–135 °С и давлении3,5–7 МПа.
Физические
свойства и строение.
Тиолы
представляют собой бесцветные соединения
с чрезвычайно неприятным запахом,
которым обнаруживается уже в ничтожных
концентрациях. Алкантиолы содержатся
в кишечных газах человека и животных,
в зловонных выделениях некоторых
животных.
АтомS
в меркаптогруппе имеет гибридизацию,
промежуточную междуsp2
и sp3.
Например, для молекулы СН3SН:
-
длины связей С–S
0,1817 нм, S–H
0,1329 нм; -
валентный угол
CSH
= 96,5°; -
энергия связи S–H
360 кДж/моль.
Потенциал
ионизациидляCH3SH
– 9,44 эВ
с
удлинением углеродной цепи понижается.
Электронная система атома серы значительно
подвижнее, чем кислоррода, что отражается
и на энергии ионизации. Тиолы являются
более сильными электронодонорами. В
молекулах тиолов угол CSH
равен 100–104°, что меньше, чем угол СОН
в алканолах. Для тиолов характерна
линейная зависимость термодинамических
величин от молекулярной массы (таблица
17).
Таблица
17 – Энергия
диссоциациисвязиС–SH
в тиолах
|
Соединение |
Eдис., |
|
CH3SH |
293,3 |
|
C2H5SH |
289,1 |
|
C3H7SH |
284,9 |
|
C4H9SH |
272,35 |
Группа
SH
обладает слабым –
I
и +M
эффектами, кислотные свойства ее
выше, а основные ниже, чем группыОН.
Связь
S–Н
менее полярна, чем связь О–Н,
поэтому у тиолов слабее межмолекулярные
водородные связи и ниже температуры
кипения, чем у соответствующих кислородных
аналогов (таблица 18).
Таблица
18 – Физические свойства некоторых
тиолов
|
Соединение |
Мr |
Тпл., |
Ткип., |
d420 |
nD20 |
|
Метантиол |
48.11 |
–123,02 |
6,02 |
0,8665 |
– |
|
Этантиол |
62,13 |
–144,40 |
35,00 |
0,8391 |
1,4310 |
|
Пропантиол |
76.16 |
–113,30 |
67,60 |
0,8411 |
1,4380 |
|
2—Пропантиол |
76,16 |
–130,54 |
52,56 |
0,8143 |
1.4255 |
|
Бутантиол |
90,19 |
–116,00 |
98,58 |
0,8416 |
1,4429 |
|
2—Метилпропантиол |
90,19 |
–140,20 |
85,15 |
0,8295 |
1,4366 |
|
Пентантиол |
104,22 |
–75,70 |
126,64 |
0,8421 |
1,4469 |
|
Циклогексантиол |
116,17 |
– |
158,0 |
0,9782 |
1,4921 |
|
Октантиол |
146,29 |
–49,20 |
77–78 |
0,8433 |
1,4540 |
|
2—Метил—2—пропантиол |
90,19 |
1,11 |
64,22 |
0.8002 |
1,4332 |
В
разбавленных растворах тиолы существуют
в виде мономеров, а в более концентрированных
– в виде димеров преимущественно
линейного строения благодаря образованию
водородных
связейS–H…S.
В жидком и твердом состоянии тиолы могут
образовывать полимеры.
Химические
свойства
1. Кислотные
свойства.
Тиолы более сильные кислоты, чем
соответствующие спирты (рК
этантиола –10,5, а этанола –18). Легкая
поляризуемость атома серы, вследствие
большего атомного радиуса и меньшей
электроотрицательностью по сравнению
с атомом кислорода, способствует
делокализации отрицательного заряда,
образующегося алкилсульфид-иона RS–
и, следовательно, повышает его стабильность.

1.1 Образование
солей.
Тиолы образуют растворимые в воде соли
тиоляты – с щелочными металлами и
нерастворимые – с тяжелыми металлами
(ртутью, свинцом, цинком). Это свойство
тиолов нашло свое отражение в названии
меркаптаны (от лат. mercuriuscaptans
– связывающий ртуть).

Способность тиолов
связывать ионы тяжелых металлов позволяет
использовать их как противоядия при
отравлениях соединениями мышьяка,
ртути, хрома, висмута.
Физические и химические особенности тиолов и сульфидов
Низшие алифатические тиолы — это легколетучие жидкости с крайне неприятным запахом.
Межмолекулярные водородные связи между молекулами тиолов слабее, чем у соответствующих спиртов, поэтому температура кипения ниже. Например, температура кипения метанола — 65$^\circ$С, а метантиола — 6$^\circ$С; темп. кип. этанола — 78$^\circ$С, а этантиола — 37$^\circ$С.
Тиолы плохо растворимы в воде, но хорошо растворяются в диэтиловом эфире, этаноле и др. органических растворителях.
Сульфиды — жидкости с эфирным запахом; имеют близкие по значению температуры кипения к значениям толуолов с той же молекулярной массой. Например, температура кипения диметилсульфида 38$^\circ$С, а этантолуола — 37$^\circ$С.
Сульфиды не растворяются в воде. По химическим свойствам являются нейтральными веществами.
У тиолов свойства кислот выражены сильнее, чем у спиртов. Для них $pKa$ изменяется в интервале 9,5-11, таким образом, гидроксид-ион способен превратить тиолы нацело в тиолат-ион:
$C_2H_5SH+OH^-\leftrightarrow C_2H_5S^-+H_2O$
Тиолы растворяются в щелочах с образованием солеобразующих соединений, которые называются тиоляты (меркаптиды) и имеют общую формулу $RSNa$:
$C_2H_5SH+NaOH\to C_2H_5SNa+H_2O$
$2C_2H_5SH+HgO\to C_2H_5S)_2Hg+H_2O$
При действии на тиолы слабых окислителей образуются дисульфиды. Сильные окислители способствуют образованию сульфокислот:
$C_2H_5SH{{\stackrel{\leftслабый\ окислитель}{\longrightarrow}}}C_2H_5-S-S-C_2H_5$
$C_2H_5SH{{\stackrel{\leftсильный\ окислитель}{\longrightarrow}}}C_2H_5-SO_3H$
При окислении тиолов, в отличие от спиртов, окисляется сера, а не углерод.
Тиолы с легкостью присоединяются к непредельным соединениям по:
-
нуклеофильному механизму
$CH_3\to CH=CH_2+RS^-\to CH_3-CHSR-\overline{C}H_2{{\stackrel{+RSH}{\longrightarrow}}}CH_3-CHSR-CH_3$
-
радикальному механизму:
$RSH+R\cdot \to RS\cdot +RH$
$CH_3CH=CH_2+RS^{\cdot }\to CH_3\dot{C}HCH_2SR{{\stackrel{+RSH}{\longrightarrow}}}CH_3CH_2CH_2SR+RS^{\cdot }$
Если на сульфиды действовать слабым окислителем, то это приведет к образованию сульфоксидов (А), а если воздействовать сильным окислителем, то образуются сульфоны (Б).
Рисунок 6.
Рисунок 7.
С алкилгалогенидами сульфиды образуют сульфониевые (тиониевые) соли.
Подготовка
Этантиол получают реакцией этилена с сероводородом над катализатором. Различные производители используют в этом процессе разные катализаторы. Он также был коммерчески получен реакцией этанола с газообразным сероводородом над кислотным твердым катализатором, таким как оксид алюминия .
Об этантиоле впервые сообщил Цейз в 1834 году. Цейзе обработал этилсульфат кальция суспензией сульфида бария, насыщенной сероводородом. Ему приписывают название группы C 2 H 5 S- меркаптом.
Этантиол можно также получить реакцией замещения галогенида , когда этилгалогенид обрабатывают водным бисульфидом натрия . Это преобразование было продемонстрировано еще в 1840 году Анри Виктором Рено .
Использует
Этантиол намеренно добавляется к бутану и пропану (см .: СНГ ) для придания легко заметного запаха этим топливам, обычно не имеющим запаха, которые представляют угрозу возгорания , взрыва и удушья .
В подземной горнодобывающей промышленности этантиол или этилмеркаптан называют «зловонным газом». Газ попадает в шахтные вентиляционные системы, чтобы предупредить горняков во время чрезвычайной ситуации. В Онтарио горное законодательство предписывает, что «система сигнализации в подземной шахте должна состоять из введения на все рабочие места достаточного количества газа этилмеркаптана или аналогичного газа, чтобы его могли легко обнаружить все рабочие».
Синтез
Алифатические тиолы
Старейшим методом получения тиолов является алкилирование гидросульфидов щелочных металлов с первичными и вторичными алкилгалогенидами, в качестве алкилирующих агентов также могут выступать алкилсульфаты или алкилсульфонаты. Реакция идёт по механизму бимолекулярного нуклеофильного замещения SN2 и проводится обычно в спиртовых растворах, поскольку тиолят-ионы также являются сильными нуклеофилами, побочной реакцией является их дальнейшее алкилирование до сульфидов, снижающее выход тиолов; для повышения выхода необходимо использовать большой избыток гидросульфида:
-
- RX+HS−→RSH+X−{\displaystyle {\mathsf {RX+HS^{-}\rightarrow RSH+X^{-}}}}
-
- RSH+HS−→RS−+H2S{\displaystyle {\mathsf {RSH+HS^{-}\rightarrow RS^{-}+H_{2}S}}}
-
- RS−+RX→R2S+X−; X=Cl, Br, I, ROSO{\displaystyle {\mathsf {RS^{-}+RX\rightarrow R_{2}S+X^{-};\ \ X=Cl,\ Br,\ I,\ ROSO}}}
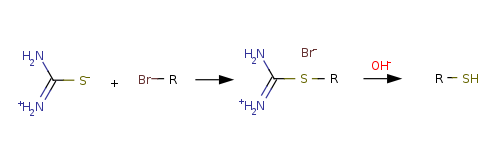
Более удобным методом синтеза тиолов является алкилирование тиомочевины с образованием алкилтиурониевых солей и их последующим щелочным гидролизом:
Преимуществом этого метода являются легкая очистка перекристаллизацией тиурониевых солей и достаточно высокие общие выходы тиолов.
Своего рода вариацией этого метода, позволяющего получить тиолы без побочного образования сульфидов, является алкилирование с последующим гидролизом ксантогенатов:
-
- C2H5CSSK+RX→C2H5CSSR+KX{\displaystyle {\mathsf {C_{2}H_{5}CSSK+RX\rightarrow C_{2}H_{5}CSSR+KX}}}
-
- C2H5CSSR+H2O→RSH+C2H5OH+CSO{\displaystyle {\mathsf {C_{2}H_{5}CSSR+H_{2}O\rightarrow RSH+C_{2}H_{5}OH+CSO}}}
или тиоацетатов:
-
- CH3COSK+RX→CH3COSR+KX{\displaystyle {\mathsf {CH_{3}COSK+RX\rightarrow CH_{3}COSR+KX}}}
-
- CH3COSR+H2O→RSH+CH3COOH{\displaystyle {\mathsf {CH_{3}COSR+H_{2}O\rightarrow RSH+CH_{3}COOH}}}
Тиолы также могут быть синтезированы из алкилгалогенидов через соли Бунте — соли S-алкилтиосульфокислот, получаемые алкилированием тиосульфата натрия, которые при кислотном гидролизе образуют тиолы:
-
- RX+Na2S2O3→RSSO3Na+NaX{\displaystyle {\mathsf {RX+Na_{2}S_{2}O_{3}\rightarrow RSSO_{3}Na+NaX}}}
-
- RSSO3Na+H2O→RSH+NaHSO4{\displaystyle {\mathsf {RSSO_{3}Na+H_{2}O\rightarrow RSH+NaHSO_{4}}}}
В условиях кислотного катализа сероводород может присоединяться к алкенам с образованием тиолов:
-
- (CH3)2C=CH2+H2S→(CH3)3CSH{\displaystyle {\mathsf {(CH_{3})_{2}C{\text{=}}CH_{2}+H_{2}S\rightarrow (CH_{3})_{3}CSH}}}
Модификацией этого метода является присоединение тиоуксусной кислоты к алкенам с дальнейшим гидролизом образовавшегося алкилтиоацетата:
-
- RCH=CH2+CH3COSH→RCH2CH2SCOCH3{\displaystyle {\mathsf {RCH{\text{=}}CH_{2}+CH_{3}COSH\rightarrow RCH_{2}CH_{2}SCOCH_{3}}}}
-
- RCH2CH2SOCCH3+OH−→RCH2CH2SH+CH3COO−{\displaystyle {\mathsf {RCH_{2}CH_{2}SOCCH_{3}+OH^{-}\rightarrow RCH_{2}CH_{2}SH+CH_{3}COO^{-}}}}
Ароматические тиолы
Ароматические тиолы могут быть синтезированы восстановлением производных ароматических сульфокислот, так, например, тиофенол синтезируется восстановлением бензолсульфохлорида цинком в кислой среде:
-
- C6H5SO2Cl→HC6H5SH{\displaystyle {\mathsf {C_{6}H_{5}SO_{2}Cl{\xrightarrow{}}C_{6}H_{5}SH}}}
Ароматические тиолы также могут быть синтезированы взаимодействием арилдиазониевых солей с гидросульфидами:
-
- ArN2X→HS−ArSH{\displaystyle {\mathsf {ArN_{2}X{\xrightarrow{HS^{-}}}ArSH}}}
или ксантогенатами:
-
- ArN2X→ROC(=S)S−ROC(=S)SAr{\displaystyle {\mathsf {ArN_{2}X{\xrightarrow{ROC({\text{=}}S)S^{-}}}ROC({\text{=}}S)SAr}}}
- ROC(=S)SAr→H2OArSH+ROH+COS{\displaystyle {\mathsf {ROC({\text{=}}S)SAr{\xrightarrow{H_{2}O}}ArSH+ROH+COS}}}
Общие методы
Общим методом синтеза алифатических и ароматических тиолов является взаимодействие реактивов Гриньяра с серой:
-
- RMgX+S→RSMgX{\displaystyle {\mathsf {RMgX+S\rightarrow RSMgX}}}
- RSMgX+H2O→RSH+Mg(OH)X{\displaystyle {\mathsf {RSMgX+H_{2}O\rightarrow RSH+Mg(OH)X}}}
Реакции
Этантиол — реагент в органическом синтезе . В присутствии гидроксида натрия он дает мощный нуклеофил EtS — . Соль можно получить количественно реакцией с гидридом натрия .
Этантиол можно окислить до этилсульфоновой кислоты с помощью сильных окислителей . Более слабые окислители, такие как оксид железа или перекись водорода, дают дисульфид , диэтилдисульфид:
- 2 EtSH + H 2 O 2 → EtS-SEt + 2 H 2 O
Как и другие тиолы, он сопоставим с сероводородом . Например, он связывается одновременно с депротонированием с «мягкими» катионами переходных металлов , такими как Hg 2+ , Cu + и Ni 2+, с образованием полимерных тиолатокомплексов, Hg (SEt) 2 , CuSEt и Ni (SEt) 2. соответственно.
Этилмеркаптан
Этилмеркаптан — легколетучая жидкость, обладает сильным неприятным запахом, токсичен, действует на центральную нервную систему, вызывая судороги, паралич и смерть. Даже в ничтожных концентрациях его пары рефлекторно вызывают тошноту, головную боль из-за отвратительного запаха. Одним из продуктов его сгорания является сернистый газ, который не только ядовит, но и коррозионно активен
При одоризации газа персонал одоризационных установок должен быть тщательно проинструктирован и должен соблюдать особые меры предосторожности при работе с ним. Переливать жидкий этилмеркаптан необходимо закрытым способом.
Этилмеркаптан частично растворим в воде, хорошо растворим в спирте, эфире, бензоле, нефти и газовом конденсате. Этилмеркаптан хранится в герметично закрытых бочках в специальных складских помещениях или под навесом вне воздействия солнечных лучей.
Этилмеркаптан взаимодействует с железом и его окислами, образуя склонные к самовозгоранию меркаптиды железа. Установлены факты самовоспламенения пирофорных отложений при — 20 С. Эти отложения состоят в основном из сернистого железа. Медленное воздействие кислорода на пирофорные отложения приводит к постепенному их окислению с выделением элементарной серы, заполняющей поры и покрывающей отложения защитной пленкой.
Этилмеркаптан и более высокомолекулярные гомологи — жидкости, нерастворимые в воде.
Этилмеркаптан производят путем синтеза из этилового спирта и сероводорода: Ш8 С2ШОН — CiHsSH ШО.
Этилмеркаптан свинца, Pb ( SC2Hs) 2 — желтое соединение, плавящееся при 150 и растворимое в хлороформе и бензоле.
Определение этилмеркаптана и образовавшегося из диметил-дисульфида метилмеркаптана производят следующим образом. Из первого поглотительного прибора отбирают для анализа 1 и 5 мл, а из второго — полный объем пробы, доводят недостающий объем до 5 мл раствором ацетата ртути, вносят по 0 5 мл составного реактива и перемешивают.
Производство этилмеркаптанов из хлористого этила было проведено в широком масштабе. Этилмеркаптан применяется в качестве исходного продукта при синтезе сульфонала, весьма распространенного снотворного средства.
Запах этилмеркаптана ощущается при содержании 0 19 г ( 0 22 мл) в 1000 м3 воздуха. Расход жидкого одоранта следует принимать из расчета 1 л на 500 — 20 000 м3 воздуха или инертного газа.
Концентрация этилмеркаптана должна составлять 16 г на 1000 м3 природного газа.
Десорбция этилмеркаптана производится отдув ко и паром при кипячении ( аналогично процессу регенерации моноэтаноламина, см. главу IV) или каким-либо газом при нагревании. Регенерация может проводиться в насадочных аппаратах, однако керамические кольца не выдерживают условий процесса и быстро разрушаются.
Расход этилмеркаптана для одоризации топливного и пускового газа в среднем равен 16 г на 1000 м3 газа.
Поведение этилмеркаптана отлично от поведения высших тиолов. Так, при встряхивании этилмеркаптана с эквимолекулярным количеством ацетата ртути получается неполный меркаптид состава C2H5SHgCl вместо полного меркаптида R — S — Hg — S — R, образующегося в случае других меркаптанов. Формула и температура плавления совпадают с литературными данными. При реакции этилмеркаптана с большим избытком насыщенного раствора сулемы получается комплекс неполного меркацтида ртути С2Н5 — S — HgCl HgCh, что соответствует данным других авторов.
|
Синтез этилмеркаптана реакцией ацетилена с сероводородом при атмосферном давлении в среде ГМФТА.| Периодический синтез ДВС из ацетилена и сероводорода в 5-литровом реакторе. |
Вынос этилмеркаптана в ловушку наблюдается только после полного превращения щелочи в гидросульфид щелочного металла, что доказано потенциометрическим титрование. По-видимому, здесь реализуется схема , представленная выше. Вероятно, этим и объясняется в данном случае его специфически ускоряющее воздействие на окислительно-восстановительные процессы.
Запах
У этантиола очень неприятный запах, который люди могут обнаружить в мельчайших концентрациях. Порог обнаружения человека составляет всего одну часть на 2,8 миллиарда частей воздуха (0,36 частей на миллиард). Его запах напоминает запах лука-порея , лука , дуриана или вареной капусты , но довольно отчетливый.
Сотрудники Калифорнийской нефтяной компании «Юнион» впервые в 1938 году сообщили, что стервятники-индюки собираются на месте утечки газа. Обнаружив, что это вызвано следами этантиола в газе, было решено увеличить количество этантиола в газе, чтобы облегчить обнаружение утечек.
Применение
За счёт сильного неприятного запаха тиолы, в частности, этантиол, используются для добавления в природные газы, не имеющие запаха, для обнаружения утечки по запаху. Согласно правилам Ростехнадзора, запах этантиола в одорированном природном газе должен ощущаться обонянием человека при концентрации природного газа в воздухе не более 20 % об. от нижнего предела взрываемости.
За счёт лёгкого гомолитического разрыва S-H связи с образованием малоактивных тиильных радикалов тиолы используются как ингибиторы радикальных цепных реакций, в частности, процессов автоокисления и радикальной полимеризации:
-
- ROO⋅+R′SH → ROOH+R′S⋅{\displaystyle {\mathsf {ROO\cdot +R’SH\ \rightarrow \ ROOH+R’S\cdot }}}
-
- ∼MM⋅+R′SH → ∼MMH+R′S⋅{\displaystyle {\mathsf {\sim MM\cdot +R’SH\ \rightarrow \ \sim MMH+R’S\cdot }}}
-
- 2R′S⋅ → R′SSR′{\displaystyle {\mathsf {2R’S\cdot \ \rightarrow \ R’SSR’}}}