Теория горения и взрыва. экзамен по теории горения и взрыва виды горения
Содержание:
- Справочная информация
- Физико-химические основы процесса горения
- Физико-химические основы тушения пожаров
- Справочная информация
- Топливо и его горение
- Горение веществ на воздухе и в кислороде
- Параметры реакции горения
- Условия возникновения и виды горения
- 1.2. Характеристика участников процесса горения
- Я.Б.Зельдович и др. Математическая теория горения и взрыва. (Зельдович Я.Б., Баренблатт Г.И., Либрович В.Б., Махвиладзе Г.М.)
- Справочная информация
- Бизнес и финансы
Справочная информация
ДокументыЗаконыИзвещенияУтверждения документовДоговораЗапросы предложенийТехнические заданияПланы развитияДокументоведениеАналитикаМероприятияКонкурсыИтогиАдминистрации городовПриказыКонтрактыВыполнение работПротоколы рассмотрения заявокАукционыПроектыПротоколыБюджетные организацииМуниципалитетыРайоныОбразованияПрограммыОтчетыпо упоминаниямДокументная базаЦенные бумагиПоложенияФинансовые документыПостановленияРубрикатор по темамФинансыгорода Российской Федерациирегионыпо точным датамРегламентыТерминыНаучная терминологияФинансоваяЭкономическаяВремяДаты2015 год2016 годДокументы в финансовой сферев инвестиционной
Физико-химические основы процесса горения
Горение – это
сложный физико-химический процесс
взаимодействия окислителя и горючего
вещества, сопровождающийся выделением
тепла и свечением.
Горение возникает
при наличии горючего вещества, окислителя
и источника воспламенения (зажигания).
В качестве окислителя в процессе горения
является
,,
бертолетова соль (KClO3),
нитро соединения и др. В качестве горючего
– многие органические соединения, сера,
,
колчедан, окись углерода, водород,
большинство металлов в свободном виде.
Важнейшие процессы
при горении – тепло и массоперенос.
Наиболее общим свойством горения
является способность возникшего очага
пламени перемещаться по всей горючей
смеси путем передачи тепла, и диффузии
активных частиц из зоны горения в свежую
смесь. В первом случае реализуется
тепловой, а во втором – диффузный
механизм распространения пламени.
Однако, как правило, горение протекает
по комбинированному тепловому
диффузионному механизму.
В зависимости от
агрегатного состояния горючего и
окислителя различают 3 вида горения:
1. Гомогенное
горение –горение газов и парообразных
горючих веществ в среде газообразного
окислителя (одинаковые агрегатные
состояния горючих веществ и продуктов
горения: например, природный газ или
водород с окислителем –
воздуха). Горение протекает с большой
скоростью и всегда заканчивается
взрывом.
2. Гетерогенное
горение – горение жидких и твердых
горючих веществ в среде газообразного
окислителя (горючее вещество и окислитель
находятся в разных агрегатных состояниях:
горение углей, металлов, сжигание жидких
топлив в нефтяных топках, двигателях
внутреннего сгорания).
3. Горение взрывчатых
веществ и порохов – связано с переходом
вещества из конденсированного состояния
в газ.
В зависимости от
скорости распространения пламени
(движение пламени по газовой смеси)
горение может быть:
1. Дефлаграционным
(нормальное)
=1÷10
м/с. Передача тепла от слоя к слою и
такое же перемещение пламени.
2. Взрывным –
=
(от десятков до сотен м/с). Взрыв – быстрое
превращение вещества, сопровождающееся
выделением энергии и образованием
сжатых газов, способных воспроизводить
работу. Ударная волна обладает
разрушительной силой при избыточном
давлении во фронте свыше 15кПа.
3. Детонационным
—
=
до 5000 м/с. – передача тепла от слоя к
слою происходит за счет ударной волны.
Другими словами – это совокупность
ударной волны и зоны химических
превращений исходных веществ. Выделяющаяся
химическая энергия подпитывает ударную
волну и не дает ей затухать (В основном
в трубопроводах).
В основе современных
представлений о механизме процесса
горения лежат 2 теории:
а) теория перекисных
окислений А.Н. Баха, сформулированная
в 1897 г. (согласно этой теории механизм
биологического окисления рассматривается
следующим образом: при активации в
молекуле кислорода разрывается одна
из связей, удерживающих атомы. В результате
образуется перекисная группа —О—О—,
которая присоединяется к окисляющемуся
соединению, образуя перекись.) Эта теория
хорошо объясняет процессы окисления,
происходящие в естественных условиях,
что позволяет предотвратить вредные
явления, протекающие при хранении и
самовозгорании. Но не объясняет действие
катализаторов.
б) цепная теория
окисления (Н. Н. Семеновым в 1927 г.),
согласно
которой выделение тепла происходит в
результате разветвления цепей реакционных
и накопления химически активных частиц
(свободные радикалы).
Согласно этой
теории, окисление идет через
последовательность промежуточных
реакций образования промежуточных
продуктов, осуществляющих переход
реагирующей системы от исходного
состояния к конечным продуктам. Такими
промежуточными продуктами могут быть
перекиси, молекулы и их “осколки” с
группой ОН, атомы водорода и кислорода,
свободные радикалы ОН, СН, СН2.
Источники зажигания:
1) Открытые (пламя).
2) Скрытые
(тепло-химические реакции, микробиологические
процессы).
При зажигании
горючая смесь сгорает постоянно. Зона
горения перемещается по смеси, обеспечивая
распространение пламени.
Физико-химические основы тушения пожаров
Существует несколько теорий и способов тушения пожаров, опирающихся на их физико-химические свойства и основы.
Тепловая теория прекращения пожара в настоящее время самая распространенная и чаще используемая при тушении возгораний. Суть теории заключается в том, что при нарушении теплового равновесия в зоне горения, химические реакции станут невозможными и пожар прекращается. Происходит это, если удается снизить температуру пламени будет снижена до критического значения, которая определяется математически.
Снижение температуры пламени можно осуществить либо путем снижения объема выделения тепла, либо повышением объема отвода тепла.
Одним из самых доступных способов прекращения горения является уменьшение температуры в зоне химических процессов. Для этого необходимо применять материалы и средства, которые смогут снизить объем тепловыделения в области реакции горения.
Для отвода тепла из области горения возможно использовать вещества, которые имеют низкую температуру, например, азот, гелий или аргон в жидком агрегатном состоянии. Однако, такое тушение мало реализуемо, из-за отсутствия необходимых веществ.
Увеличить объем теплоотвода возможно и механическим способом, используя вещество с большой теплоемкостью, внеся его в фронт пламени. Чаще всего для этого используется металлическая стружка.
Определение 3
Фронт пламени представляет собой узкую зону распространяющегося огня, где и происходит горение.
Теплоотдача также увеличивается, если ввести в пламя теплоемкий материал или продукт с высокой дисперсностью, например песок или специальный порошок. Но при этом способе процесс увеличения теплоотдачи не является доминирующим.
Также увеличить теплоотдачу можно вводом в зону возгорания веществ, которые способны изменить цвет пламени, делая его более ярким. Из-за этого возрастают теплозатраты на излучение. Данный способ возможен только теоретически, но на практике он не применяется, из-за наличия более подходящих способов.
Обычно для отвода тепла применяют вещества, которые имеют большую теплоту фазового перехода, например, воду или твердый диоксид углерода.
Теперь можно рассмотреть способы снижения тепловыделения в зоне горения.
- Первый способ – изменение состава воздуха, который поддерживает процесс горения. Осуществляется путем снижения содержания кислорода в воздухе, благодаря добавлению в него инертных добавок.
- Второй способ представляет собой уменьшение до критического значения объема окислителя в зоне горения, путем изоляции горючих компонентов друг от друга.
- Третий способ представляет собой замедление химических реакций, путем введения соответствующих реагентов.
Изучение пожаров, причин их протекания и возникновения, а также разработка способов их тушения являются неотъемлемой частью соблюдения безопасности производства и предотвращения чрезвычайных ситуаций.
Справочная информация
ДокументыЗаконыИзвещенияУтверждения документовДоговораЗапросы предложенийТехнические заданияПланы развитияДокументоведениеАналитикаМероприятияКонкурсыИтогиАдминистрации городовПриказыКонтрактыВыполнение работПротоколы рассмотрения заявокАукционыПроектыПротоколыБюджетные организацииМуниципалитетыРайоныОбразованияПрограммыОтчетыпо упоминаниямДокументная базаЦенные бумагиПоложенияФинансовые документыПостановленияРубрикатор по темамФинансыгорода Российской Федерациирегионыпо точным датамРегламентыТерминыНаучная терминологияФинансоваяЭкономическаяВремяДаты2015 год2016 годДокументы в финансовой сферев инвестиционной
Топливо и его горение
Основным источником энергии для металлургической промышленности является топливо.
Под топливом понимают вещество, горение которого сопровождается выделением значительного количества тепла и которое отвечает следующим требованиям:
-
запасы должны быть достаточными для того, чтобы их было экономически выгодно добывать и попользовать;
-
продукты сгорания должны легко удаляться из зоны горения;
-
продукты сгорания должны быть безвредны для окружающего мира и самих тепловых устройств;
-
процесс горения должен быть легко управляем.
Этим требованиям отвечают органические соединения, содержащие углерод С и водород Н и их соединения.
Все виды топлива подразделяют на естественное и искусственное, каждое из которых в свою очередь подразделяются на твердое, жидкое, газообразное.
Химический состав топлива.
Топливо состоят из горючей массы и балласта. К горючим компонентам относятся С, Н, S (сера органическая и колчеданная). В состав топлива входят азот N (не горит, теплоноситель), кислород О (окисляет горючие компоненты).
Кроме этого в топливе всегда присутствуют вода и зола. Вода, содержащаяся в топливе, подразделяется на гигроскопическую, химически связанную и внешнюю, которая механически удерживается в топливе и теряется при сушке.
Зола – это негорючая минеральная часть топлива, состоящая из Al2O3, Fe2O3, Si2O3, CaO и др.
Элементарный анализ топлива.
|
Индекс |
Состав |
|||||
|
C |
H |
O |
N |
S |
A |
W |
|
О |
органическая масса |
|||||
|
Г |
горючая масса |
|||||
|
С |
сухая масса |
|||||
|
Р |
рабочая масса |
Состав рабочего топлива:
СР + HР + OР + NР + SР + AР + WР = 100%
Пересчет состава топлива с любой массы на рабочее топливо выполняется по одному из следующих выражений:
Теплота сгорания топлива.
Количество выделившегося тепла при сжигании топлива связано с химическим составом топлива.
Количество тепла, которое выделяется при сжигании единицы топлива, называется теплотой сгорания топлива Q. Ее размерности: кДж/кг (ккал/кг), кДж/м3 (ккал/м3) или кДж/кмоль (ккал/кмоль).
В технике различают высшую Qв и низшую Qн теплоту сгорания топлива. Под низшей теплотой сгорания понимают то количество тепла, которое выделяется при сжигании единицы топлива до продуктов полного сжигания при условии, что вода, содержащаяся в продуктах сгорания, находится в виде пара, охлажденного до 20оС.
Теплота сгорания топлива определяется по следующим формулам:
для твердого и жидкого топлива:
для газообразного:
,
где CP, HP, CO, H2 и т.д. – составляющие топлив, %;
4, 187кДж = 1ккал.
Условное топливо.
Для удобства планирования, учета и сравнения различных видов топлива введено понятие условного топлива, которое характеризуется низшей теплотой сгорания
.
Для перевода натурального топлива в условное находится эквивалент данного топлива:
для твердого и жидкого:
для газообразного:
.
Перерасчет расхода натурального топлива Вр на условное Ву осуществляется по формуле:
Газообразное топливо.
Газообразное топливо по сравнению с твердым и жидким топливом обладает следующими преимуществами:
-
возможностью лучшего смешения газа с воздухом и, следовательно, сжиганием с меньшим избытком воздуха;
-
легкостью подогрева перед сжиганием;
-
отсутствием золы;
-
транспортабельностью и удобством учета расхода газа;
-
простотой обслуживания горелочных устройств.
Недостатки: взрывоопасность, малая объемная масса (требуются большие емкости для хранения).
Природный газ – наиболее дешевое топливо. Его основным горючим компонентом является метан CH4 = 95%.
Искусственные газы:
-
коксовый газ – продукт коксования углей;
горючие компоненты – Н2 = 46-60%; СН4 = 20-30%; МДж/м3;
-
доменный (колошниковый) газ получают в процессе доменной плавки, содержит около 30% СО; МДж/м3.
Жидкое топливо.
Естественное жидкое топливо – нефть. Как топливо ее используют редко.
Искусственное жидкое топливо – это продукты переработки нефти: бензин, лигроин, керосин, газойль и др. Остаток переработки – мазут. Мазут – топливо металлургической промышленности и энергетики. Перед сжиганием мазут нагревают до 70-80оС с целью понижения его вязкости. Состав мазута – это соединения углеродов. С = 85-88%; Н2 = 10%; МДж/кг.
Твердое топливо.
Это каменный и бурый угли, антрацит, горючие сланцы, торф.
Основной метод переработки угля – коксование, заключающийся в сухой перегонке топлива путем нагрева угля без доступа воздуха при температурах 900-1100оС в коксовых печах. Получается спекшийся кокс, пористый, механически прочный, применяемый в металлургии, в основном для выплавки чугуна. Содержание С=75-85%; МДж/кг.
Горение веществ на воздухе и в кислороде
Вы уже знаете, что в состав окружающего нас воздуха входит кислород. Поэтому многие вещества горят не только в чистом кислороде, но и на воздухе.
Горение на воздухе протекает чаще всего гораздо медленнее, чем в чистом кислороде. Происходит это потому, что в воздухе лишь одна пятая часть по объему приходится на кислород. Если уменьшить доступ воздуха к горящему предмету (а следовательно, уменьшить доступ кислорода), горение замедляется или прекращается. Отсюда понятно, почему для тушения загоревшегося предмета на него следует набросить, например, одеяло или плотную тряпку.
При пожарах для тушения горящих предметов часто используют пену (рис. 84). Она обволакивает горящий предмет и прекращает доступ к нему кислорода. Горение сначала замедляется, а затем прекращается совсем.
Некоторые вещества, быстро сгорающие в кислороде, на воздухе не горят вообще. Так, если нагреть железную проволоку на воздухе даже до белого каления, она все равно не станет гореть, тогда как в чистом кислороде быстро сгорает с образованием раскаленных искр.
Краткие выводы урока:
- При обычных условиях кислород — газ, не имеющий цвета, запаха и вкуса, плохо растворимый в воде.
- Кислород обладает высокой химической активностью. Он вступает в химические реакции со многими простыми и сложными веществами.
- Химические реакции, протекающие с выделением большого количества теплоты и света, называют реакциями горения.
- В чистом кислороде вещества горят намного быстрее, чем на воздухе.
Надеюсь урок 18 «Физические и химические свойства кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Параметры реакции горения
Горение
возникает при наличии горючего вещества,
окислителя и источника воспламенения.
В реальных условиях окислителем является
кислород воздуха. При горении систем,
не содержащих газообразных частей и
состоящих только из твёрдых или жидких
фаз – пламя может не возникать, то есть
происходит беспламенное горение или
тление.
Окислитель
– обычно это кислород воздуха, но могут
быть и другие (горение металлов в среде
хлора). В зависимости от состава различные
горючие вещества требуют определённого
количества окислителя.
Теоретически
необходимое количество воздуха для
получения продуктов полного
горения:
Окись
углерода 1 кг – 2,5 кг воздуха
Метан
1 кг — 17,2 кг воздуха
Бензин
1 кг – 15 кг воздуха
На
практике
полное сжигание не может быть осуществлено
без избыточного количества воздуха.
Оно зависит от методов сжигания и
находится в пределах от 15 до 50%.
Продукты
горения большинства веществ газообразны
и при достаточном количестве воздуха
состоят из водяного пара и углекислого
газа. Присутствуют также окиси азота и
серы в малых кол-вах. В случае недостаточного
кол- ва воздуха,т.е. неполного сгорания,
в состав продуктов горения могут так
же входить метан, окись углерода и
водород.
Теплота
горения.
Каждое горючее вещ-во хар-ся высшей и
низшей теплотворной способностью.
Высшая теплотворность- это кол-во тепла,
кот. Выделится при сгорании и при послед.
Конденсации влаги, содерж-ся в продуктах
горения. Если влага остается в газообразном,
парообразном сост, то это низкая
теплотворность.
Температура
горения- это
температура до которой в процессе
горения нагреваются продукты горения
и исходного горючего вещ-ва. Если
предполагать что все тепло при сгорании
топлива идет на нагрев продуктов горения
то t
горения будет наз-ся теоретической.
Действительная температура всегда ниже
и определяется следующим:
1)кол-вом
тепла, выделяемом при горении.
2)составом
и кол-вом продуктов горения
3)кол-вом
тепла, отданного в окр.среду.
Скорость
горения определяется
временем, в течении которого сгорает
определённое количество горючего
вещества. На практике скорость горения
определяется временем в течении которого
происходят чисто физические процессы:
теплопередачи, излучения, испарения и
др. Совокупность всех этих процессов
определяет реальную скорость горения,
на которую оказывают влияние следующие
факторы:
-
Природа
горючего вещества( тв, ж, г) -
Концентрация
вещества -
Давление
и температура.
3.
Механизм процесса горения (4+5)
Условия возникновения и виды горения
Все разнообразие процессов горения может быть сведено к двум основным явлениям: возникновению и распространению пламени. Появлению пламени всегда предшествует процесс прогрессирующего самоускорсния реакции, вызванный изменением внешних условий: появлением в горючей среде источника зажигания, нагревом смеси горючего с окислителем до некоторой критической температуры стенками аппарата или в результате адиабатического сжатия и т. д.
Общая схема возникновения пламени показана на рис. 9.1. Зажигание горючей смеси инициируется внешним источником зажигания (электрической или фрикционной искрой, высоконагретой поверхностью, открытым пламенем). Если ограничиться рассмотрением зажигания газовой смеси искрой, то процесс зажигания может быть представлен в следующем виде.
Температура в канале электрической искры достигает 10000 °С. В этой зоне происходит термическая диссоциация и ионизация молекул, что приводит к интенсивному протеканию химических реакций. Однако, вызвав горение в зоне разряда, искра может не вызвать дальнейшего распространения пламени по смеси. Горючую смесь может зажечь только такая искра, в канале которой выделяется энергия, достаточная для обеспечения условий распространения пламени на весь объем смеси.
В модели зажигания, предложенной Я.Б. Зельдовичем, действие искрового разряда приравнено к действию точечного теплового источника, который в момент времени т = 0 выделяет Q кДж тепла.
За счет этого тепла он нагревает вокруг себя до достаточно высокой температуры сферический объем газа радиусом г. За счет теплообмена с окружающим газом температура первоначального объема будет понижаться. Критические условия зажигания искровым разрядом газовой смеси характеризуются следующим выражением:
, 9.1
где r — радиус начального ядра пламени; бпл — ширина фронта ламинарного пламени.
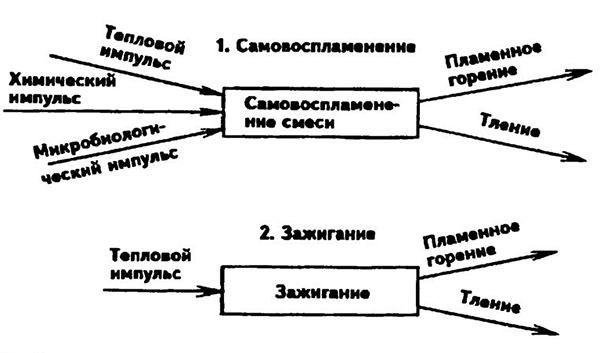
Рис. 9.1. Схема процессов самовоспламенения и зажигания
При выполнении условия (9.1) близлежащие слои горючей смеси успевают воспламениться прежде, чем нагретый искрой объем остынет.
Если для процесса зажигания решающими факторами являются температура источника зажигания и величина первоначально нагретого объема, то для процесса самовоспламенения основное значение имеют условия концентрации тепла. Процесс самовоспламенения будет рассмотрен далее.
При горении химически неоднородных горючих систем, т. е. систем, в которых горючее вещество и воздух не перемешаны и имеют поверхности раздела (твердые материалы и жидкости; струи паров и газов, поступающие в воздух), время диффузии кислорода к горючему веществу несоизмеримо больше времени, необходимого для протекания химической реакции. В этом случае процесс протекает в диффузионной области. Такое горение называют диффузионным. Все пожары представляют собой диффузионное горение.
Если время физической стадии процесса оказывается несоизмеримо меньше времени, необходимого для протекания химической реакции, то можно принять, что время сгорания химически неоднородной системы примерно равно времени протекания самой химической реакции. Скорость процесса практически определяется только скоростью химической реакции.
Такое горение называют кинетическим, например горение химически однородных горючих систем, в которых молекулы кислорода хорошо перемешаны с молекулами горючего вещества и не затрачивается время на смесеобразование. Поскольку скорость химической реакции при высокой температуре велика, горение таких смесей происходит мгновенно, в виде взрыва.
Если продолжительность химической реакции и физическая стадия процесса горения соизмеримы, то горение протекает в так называемой промежуточной области, в которой на скорость горения влияют как химические, так и физические факторы.
Пространство, в котором сгорают пары и газы, называется пламенем, или факелом. В случае, когда горит заранее не подготовленная смесь паров или газов с воздухом, пламя называют диффузионным. Если такая смесь образуется в пламени в процессе горения, — пламя кинетическое. В условиях пожара газы, жидкости и твердые вещества горят диффузионным пламенем.
Наиболее характерным свойством возникновения очага пламени является его способность к самопроизвольному распространению по горючей смеси. В понятие распространение пламени объединены разнообразные явления, сопровождающиеся образованием дефлаграционных (распространяющихся с дозвуковой скоростью) и детонационных (распространяющихся со сверхзвуковой скоростью) пламен.
1.2. Характеристика участников процесса горения
Известно, что для возникновения горения необходимо наличие:
1.Горючего вещества
2.Окислителя
3.Источника зажигания (энергетический импульс)
Эти три составляющие часто называют треугольником пожара. Если исключить одну из них, то горение возникнуть не может. Это важнейшее свойство треугольника используется на практике для предотвращения и тушения пожаров.
После возникновения горения источником зажигания далее является само пламя.
Горючие вещества и материалы
Горючие вещества и материалы классифицируют по химической природе, происхождению, агрегатному состоянию, дисперсности и т.д.
По химической природе горючие вещества и материалы подразделяются на два основных класса: органические и неорганические (рис. 1.1). Такое подразделение весьма условно, поскольку многие органические вещества содержат как в химически связанном, так и в виде примесей неорганические компоненты, нелетучая часть которых остается в виде золы, шлаков и.т.п.
Органические горючие вещества – это все вещества на основе угле-
рода, представляющие собой материалы растительного и животного происхождения, или же ископаемые вещества, т.е. добываемые из недр земли. Все они применяются как в натуральном виде, так и после соответствующей обработки.
Неорганические горючие вещества и материалы представляют со-
бой все простые и сложные вещества неорганической природы, способные к реакциям горения. По современной химической классификации это мталлы и неметаллы, их различные производные.
Я.Б.Зельдович и др. Математическая теория горения и взрыва. (Зельдович Я.Б., Баренблатт Г.И., Либрович В.Б., Махвиладзе Г.М.)
В монографии с единых позиций излагаются математические и физико-химические основы современной теории горения и взрыва. Она обобщает теоретические исследования по тепловому и цепному взрыву, теории поджигания, инициированию волны химического превращения, распространению ламинарного пламени, критическим явлениям при горении (устойчивости, пределам распространения, переходу от одного режима горения к другому), диффузионному горению неперемешанных газов и другим вопросам механики реагирующего газа. ОГЛАВЛЕНИЕ Глава 1 ВВЕДЕНИЕ. ФУНДАМЕНТ НАУКИ О ГОРЕНИИ:ОСНОВНЫЕ ФИЗИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ И ПОНЯТИЯ§ 1. Некоторые сведения из химической кинетики и термохимии§ 2. Самоускоряющиеся химические реакции и критические явления — взрыв и самовоспламенение. Теория Н. Н. Семенова§ 3. Гомогенный химический реактор идеального перемешивания § 4. Ламинарные пламенаГлава 2 СТАЦИОНАРНАЯ ТЕОРИЯ ТЕПЛОВОГО ВЗРЫВА § 1. Основные предпосылки теории§ 2. Условия теплового взрыва§ 3. Устойчивость решений стационарной теории теплового взрыва § 4. Некоторые общие свойства решений стационарной теории теплового взрыва в сосудах произвольной формы § 5. Численное исследование теплового взрыва. Эксперименты § 6. Применение идеи теплового взрыва в механике полимеров Глава 3 ИНИЦИИРОВАНИЕ ВОЛНЫ ХИМИЧЕСКОГО ПРЕВРАЩЕНИЯ В ГОРЮЧЕЙ СМЕСИ. СТАЦИОНАРНЫЕ ПОСТАНОВКИ ЗАДАЧ§ 1. Поджигание горючей смеси нагретыми поверхностями§ 2. Стационарная теория поджигания накаленными поверхностями как промежуточная асимптотика нестационарного процесса§ 3. Инициирование химической реакции активными центрамиГлава 4 ЛАМИНАРНОЕ ПЛАМЯ § 1. Уравнения теории распространения пламени§ 2. О существовании и единственности стационарного решения системы уравнений теории распространения пламени§ 3. Скорость и структура фронта пламени при большой энергии активации химической реакции§ 4. Спектр скоростей распространения пламени при скорости реакции, исчезающей в начальном состоянии. Распространение цепных изотермических пламен § 5. Формирование стационарного фронта ламинарного пламени§ 6. Диффузионно-тепловая устойчивость ламинарных пламен§ 7. Пламя в потоке с градиентом скорости. «Растяжение» пламени § 8. Индукционный режим горенияГлава 5 СЛОЖНЫЕ И ЦЕПНЫЕ РЕАКЦИИ В ПЛАМЕНАХ§ 1. Теория пламени с многостадийным превращением: цель и методы§ 2. Пламена с неразветвленными цепными реакциями§ 3. Пламена с разветвленными цепными реакциями§ 4. Простые брутто-схемы многостадийных химических превращений в пламенах§ 5. Холодные (изотермические) пламенаГлава 6 ГАЗОДИНАМИКА ГОРЕНИЯ§ 1. Перемещение пламени в потоке газа. Условие стационарного горения§ 2. Горение в закрытых сосудах. Махе-эффект§ 3. Гидродинамическая неустойчивость пламени§ 4. Ускорение пламени и возникновение детонации в трубахГлава 7 ДИФФУЗИОННОЕ ГОРЕНИЕ ГАЗОВ § 1. Общие свойства диффузионных пламен. Поверхность горения§ 2. Задача Бурке—Шумана§ 3. Предел диффузионного горения неперемешанных газов $ 4. Диффузионное пламя противонаправленных струй окислителя и горючегоДругие книги автора:Элементы математической физикиВысшая математика для начинающих и ее приложении к физике.Строение и эволюция Вселенной.Драма идей в познании природыФизика ударных волн и высокотемпературных гидродинамических явленийВысшая математика для начинающих физиков и техников
Издатель: Наука
Год издания: 1980
Страниц: 480
Качество: 5
Справочная информация
ДокументыЗаконыИзвещенияУтверждения документовДоговораЗапросы предложенийТехнические заданияПланы развитияДокументоведениеАналитикаМероприятияКонкурсыИтогиАдминистрации городовПриказыКонтрактыВыполнение работПротоколы рассмотрения заявокАукционыПроектыПротоколыБюджетные организацииМуниципалитетыРайоныОбразованияПрограммыОтчетыпо упоминаниямДокументная базаЦенные бумагиПоложенияФинансовые документыПостановленияРубрикатор по темамФинансыгорода Российской Федерациирегионыпо точным датамРегламентыТерминыНаучная терминологияФинансоваяЭкономическаяВремяДаты2015 год2016 годДокументы в финансовой сферев инвестиционной
Бизнес и финансы
БанкиБогатство и благосостояниеКоррупция(Преступность)МаркетингМенеджментИнвестицииЦенные бумагиУправлениеОткрытые акционерные обществаПроектыДокументыЦенные бумаги — контрольЦенные бумаги — оценкиОблигацииДолгиВалютаНедвижимость(Аренда)ПрофессииРаботаТорговляУслугиФинансыСтрахованиеБюджетФинансовые услугиКредитыКомпанииГосударственные предприятияЭкономикаМакроэкономикаМикроэкономикаНалогиАудитМеталлургияНефтьСельское хозяйствоЭнергетикаАрхитектураИнтерьерПолы и перекрытияПроцесс строительстваСтроительные материалыТеплоизоляцияЭкстерьерОрганизация и управление производством