Метантиол
Содержание:
- Производные
- Подготовка
- Бизнес и финансы
- Бизнес и финансы
- Разновидности вредных веществ
- 1.3 Взаимодействие с оксидами:
- Подготовка
- Другие биохимические пути
- Биологическая роль
- Использует
- Тиильные радикалы
- Применение
- Вхождение
- Протеиногенная аминокислота
- Реакции
- Справочная информация
- 3.3 Получение тиоэфиров:
- Как нужно измерять концентрацию вредных элементов
- Дополнительные принадлежности (по отдельному заказу):
Производные
S- аденозил-метионин
S- аденозилметионин — это кофактор, производный от метионина.
Производное метионина S- аденозилметионин (SAM) является кофактором, который служит в основном донором метила . SAM состоит из молекулы аденозила (через 5 ‘углерод), присоединенной к сере метионина, что делает его катионом сульфония (т. Е. Тремя заместителями и положительным зарядом). Сера действует как мягкая кислота Льюиса (т. Е. Донор / электрофил), которая позволяет S- метильной группе переноситься в кислород, азот или ароматическую систему, часто с помощью других кофакторов, таких как кобаламин (витамин B12 у людей ). Некоторые ферменты используют SAM для инициирования радикальной реакции; они называются радикальными ферментами SAM . В результате переноса метильной группы получается S-аденозил-гомоцистеин. У бактерий он либо регенерируется путем метилирования, либо спасается путем удаления аденина и гомоцистеина, в результате чего дигидроксипентандион самопроизвольно превращается в аутоиндуктор-2 , который выводится как ненужный продукт / сигнал кворума.
Подготовка
Этантиол получают реакцией этилена с сероводородом над катализатором. Различные производители используют в этом процессе разные катализаторы. Он также был коммерчески получен реакцией этанола с газообразным сероводородом над кислотным твердым катализатором, таким как оксид алюминия .
Об этантиоле впервые сообщил Цейз в 1834 году. Цейзе обработал этилсульфат кальция суспензией сульфида бария, насыщенной сероводородом. Ему приписывают название группы C 2 H 5 S- меркаптом.
Этантиол можно также получить реакцией замещения галогенида , когда этилгалогенид обрабатывают водным бисульфидом натрия . Это преобразование было продемонстрировано еще в 1840 году Анри Виктором Рено .
Бизнес и финансы
БанкиБогатство и благосостояниеКоррупция(Преступность)МаркетингМенеджментИнвестицииЦенные бумагиУправлениеОткрытые акционерные обществаПроектыДокументыЦенные бумаги — контрольЦенные бумаги — оценкиОблигацииДолгиВалютаНедвижимость(Аренда)ПрофессииРаботаТорговляУслугиФинансыСтрахованиеБюджетФинансовые услугиКредитыКомпанииГосударственные предприятияЭкономикаМакроэкономикаМикроэкономикаНалогиАудитМеталлургияНефтьСельское хозяйствоЭнергетикаАрхитектураИнтерьерПолы и перекрытияПроцесс строительстваСтроительные материалыТеплоизоляцияЭкстерьерОрганизация и управление производством
Бизнес и финансы
БанкиБогатство и благосостояниеКоррупция(Преступность)МаркетингМенеджментИнвестицииЦенные бумагиУправлениеОткрытые акционерные обществаПроектыДокументыЦенные бумаги — контрольЦенные бумаги — оценкиОблигацииДолгиВалютаНедвижимость(Аренда)ПрофессииРаботаТорговляУслугиФинансыСтрахованиеБюджетФинансовые услугиКредитыКомпанииГосударственные предприятияЭкономикаМакроэкономикаМикроэкономикаНалогиАудитМеталлургияНефтьСельское хозяйствоЭнергетикаАрхитектураИнтерьерПолы и перекрытияПроцесс строительстваСтроительные материалыТеплоизоляцияЭкстерьерОрганизация и управление производством
Разновидности вредных веществ
В перечень вредных элементов включается 850 наименований. Они подразделяются на четыре категории:
- Чрезвычайно опасные – опасной считается концентрация меньше 0,1 мг/метр (к примеру, это ртуть, свинец).
- С высокой опасностью – концентрация свыше 0,1-1 мг/метр (хлор и серная кислота).
- Умеренно опасные – концентрация 1-10 мг/метр (метиловый спирт).
- С низкой опасностью – концентрация больше 10 мг/метр (аммиак и ацетон).
Вредные элементы также распределяются по группам по виду воздействия:
- Раздражающие элементы (аммиак и хлор).
- Удушающие вещества (оксид углерода).
- Наркотические элементы (ацетон).
- Соматические (мышьяк и свинец).
- Общетоксичные (ртуть и оксид углерода).
- Аллергены (альдегиды).
- Канцерогенные элементы, которые могут спровоцировать развитие рака (асбест, ароматические углероды).
- Мутагенные (свинец и формальдегид).
- Воздействующие на репродуктивную систему (свинец и марганец).
ВНИМАНИЕ! Разделение по группам опасности имеет важный смысл. Чем более высокий класс опасности, тем меньше концентрации элемента нужно для нанесения вреда
1.3 Взаимодействие с оксидами:

2. Нуклеофильные
свойства.
Многие реакции тиолов протекают по
ионному механизму с участием тиолат-анионов,
обладающих сильными нуклеофильными
свойствами. Тиолат-анионы генерируются
из тиолов в растворах NaOH, триэтаноламина,пиридинаи др., а также образуются при взаимодействии
эфиров тиолов (например,CH3COSR)
с сильными основаниямив неводных средах либо пригидролизетиомочевины.
2.1 Реакции с
галогенидами металлов.
Тиолат-анионы легко замещают атомыгалогена(обычноСl)
в галогенидахВ,
Si,
Sn,
Ge,
P,
Мо
и других, например:



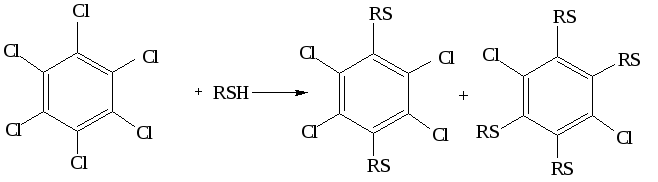
2.2 Реакции
тиолат-анионов с алкилхлоридами
протекают в жидком NH3,
с гексахлор- и гексафторбензолом– в средеэтиленгликоляилипиридина(гексабромбензол с тиолат-анионами не
реагирует), например:
Подготовка
В промышленности метантиол получают реакцией сероводорода с метанолом . Этот метод используется для промышленного синтеза метантиола :
- СН 3 ОН + Н 2 S → СН 3 SH + Н 2 О
Такие реакции проводятся в присутствии кислотных катализаторов. Другой основной путь получения тиолов включает добавление сероводорода к алкенам. Такие реакции обычно проводят в присутствии кислотного катализатора или УФ-света. Также использовалось замещение галогенидов с использованием подходящего органического галогенида и сероводорода натрия.
Другой метод включает алкилирование гидросульфида натрия .
- RX + NaSH → RSH + NaX (X = Cl, Br, I)
Этот метод используется для производства тиогликолевой кислоты из хлоруксусной кислоты .
Лабораторные методы
В общем, на типичном лабораторный масштабе, прямая реакция галогеналкана с гидросульфидом натрия в эффективном за счет конкурирующего формирования сульфидов. Вместо этого алкилгалогениды превращаются в тиолы посредством S- алкилирования тиомочевины . Этот многоэтапный процесс в одном реакторе протекает через промежуточную соль изотиоурония , которая гидролизуется на отдельной стадии:
- CH 3 CH 2 Br + SC (NH 2 ) 2 → [CH 3 CH 2 SC (NH 2 ) 2 ] Br
- [CH 3 CH 2 SC (NH 2 ) 2 ] Br + NaOH → CH 3 CH 2 SH + OC (NH 2 ) 2 + NaBr
Тиомочевина хорошо работает с первичными галогенидами, особенно активированными. Вторичные и третичные тиолы получить труднее. Вторичные тиолы могут быть получены из кетона через соответствующие дитиокетали . Родственный двухстадийный процесс включает алкилирование тиосульфата с образованием тиосульфоната (« соль Бунте ») с последующим гидролизом. Метод проиллюстрирован одним синтезом тиогликолевой кислоты :
- ClCH 2 CO 2 H + Na 2 S 2 O 3 → Na [O 3 S 2 CH 2 CO 2 H] + NaCl
- Na [O 3 S 2 CH 2 CO 2 H] + H 2 O → HSCH 2 CO 2 H + NaHSO 4
Литийорганические соединения и реактивы Гриньяра реагируют с серой с образованием тиолатов, которые легко гидролизуются:
- RLi + S → RSLi
- RSLi + HCl → RSH + LiCl
Фенолы можно превратить в тиофенолы путем перегруппировки их O -арилдиалкилтиокарбаматов.
Тиолы получают восстановительным деалкилированием сульфидов, особенно производных бензила и тиоацеталей.
Тиофенолы получают S -арилированием или заменой уходящей группы диазония на сульфгидрильный анион (SH — ):
- ArN 2 + + SH — → ArSH + N 2
Другие биохимические пути
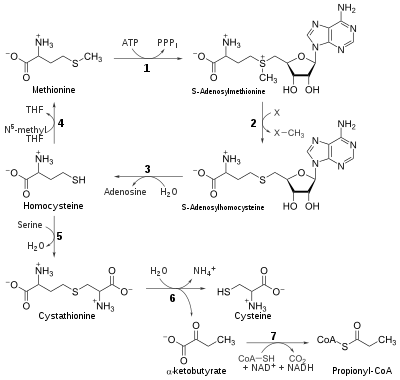
Судьба метионина
Хотя млекопитающие не могут синтезировать метионин, они все же могут использовать его в различных биохимических путях:
Катаболизм
Метионин превращается в S-аденозилметионин (SAM) с помощью (1) метионинаденозилтрансферазы .
SAM служит донором метила во многих (2) реакциях метилтрансферазы и преобразуется в S- аденозилгомоцистеин (SAH).
(3) Цистеин аденозилгомоцистеиназы
.
Регенерация
Метионин можно регенерировать из гомоцистеина через (4) метионинсинтазу в реакции, которая требует витамина B 12 в качестве кофактора .
Гомоцистеин также можно реметилировать с использованием глицин-бетаина (NNN-триметилглицин, TMG) до метионина с помощью фермента бетаин-гомоцистеинметилтрансферазы (EC2.1.1.5, BHMT). BHMT составляет до 1,5% всех растворимых белков печени, и недавние данные свидетельствуют о том, что он может иметь большее влияние на гомеостаз метионина и гомоцистеина, чем метионинсинтаза.
Путь обратного трансульфурилирования: превращение в цистеин
Гомоцистеин можно превратить в цистеин.
- (5) Цистатионин-β-синтаза (фермент, который требует активной формы витамина B6 , пиридоксальфосфата ) объединяет гомоцистеин и серин для производства цистатионина . Вместо разложения цистатионина посредством цистатионин-β-лиазы , как в биосинтетическом пути, цистатионин расщепляется до цистеина и α-кетобутирата через (6) цистатионин-γ-лиазу .
- (7) Фермент α-кетокислота дегидрогеназа превращает α-кетобутират в пропионил-КоА , который метаболизируется до сукцинил-КоА в трехступенчатом процессе (см. Пропионил-КоА ).
Синтез этилена
Эта аминокислота также используется растениями для синтеза этилена . Этот процесс известен как цикл Ян или цикл метионина.
Цикл Ян
Биологическая роль
Смесь тиолов содержится в веществе, выделяемом скунсами, а также в продуктах гниения белков.
Аминокислота цистеин HSCH2CH(NH2)COOH содержащая меркаптогруппу, входит в состав многих белков, окисление цистеина с образованием дисульфидных мостиков в ходе посттрансляционной модификации белков является важнейшим фактором при формировании их третичной структуры, высокая механическая прочность кератинов обусловлена, в том числе, и высокой степенью сшитости за счёт образования большого количества дисульфидных мостиков: так, например, содержание цистеина в кератине волоса человека, составляет ~14 %.
Трипептид глутатион, в состав которого также входит цистеин, является коферментом глутатионпероксидаз и играет важную роль в окислительно-восстановительных процессах в живых организмах.
Также существенное биологическое значение имеет метаболическое нитрозирование тиолов: глутатион и цистеиновые остатки белков при взаимодействии с активными формами азота образуют S-нитрозопроизводные, которые являются физиологическим депо оксида азота.
Использует
Баллон метантиола газа
Метантиол в основном используется для производства незаменимой аминокислоты метионина , который используется в качестве диетического компонента в кормах для домашней птицы и животных. Метантиол также используется в пластмассовой промышленности в качестве замедлителя радикальной полимеризации и в качестве прекурсора при производстве пестицидов .
Этот химикат также используется в газовой промышленности в качестве одоранта, так как он хорошо смешивается с метаном. Характерный запах смеси «тухлых яиц» широко известен потребителям природного газа как индикатор возможной утечки газа , даже очень незначительной.
Тиильные радикалы
Свободные радикалы, полученные из меркаптанов, называемые тиильными радикалами , обычно используются для объяснения реакций в органической химии и биохимии . Они имеют формулу RS •, где R представляет собой органический заместитель, такой как алкил или арил . Они возникают или могут быть сгенерированы рядом маршрутов, но основным методом является абстрагирование H-атома от тиолов. Другой метод включает гомолиз органических дисульфидов. В биологии тиильные радикалы ответственны за образование дезоксирибонуклеиновых кислот, строительных блоков ДНК . Это превращение катализируется рибонуклеотидредуктазой (см. Рисунок). Промежуточные продукты тиила также образуются при окислении глутатиона , антиоксиданта в биологии. Тиильные радикалы (с центром в сере) могут превращаться в радикалы с центром в углероде через равновесие обмена атомами водорода . Образование углеродных радикалов может привести к повреждению белка из-за образования связей C- C или фрагментации основной цепи.
Из — за слабости SH связи, тиолы могут функционировать в качестве акцепторов от свободных радикалов .
Применение
Метантиол используется в производстве аминокислоты метионина, использующейся в качестве кормовой добавки, из акролеина H2C=CH−CHO{\displaystyle {\ce {H2C=CH-CHO}}}.
На первой стадии присоединением метантиола к акролеину синтезируют 3-метилтиопропионовый альдегид:
- CH3SH+H2C=CH−CHO⟶CH3SCH2CH2CHO,{\displaystyle {\ce {CH3SH + H2C=CH-CHO -> CH3SCH2CH2CHO,}}}
который далее используется в качестве карбонильного компонента в синтезе Штреккера:
- CH3SCH2CH2CHO+HCN+NH3⟶CH3SCH2CH2CH(NH2)CN;{\displaystyle {\ce {CH3SCH2CH2CHO + HCN + NH3 -> CH3SCH2CH2CH(NH2)CN;}}}
- CH3SCH2CH2CH(NH2)CN+H2O⟶CH3SCH2CH2CH(NH2)COOH⋅{\displaystyle {\ce {CH3SCH2CH2CH(NH2)CN + H2O -> CH3SCH2CH2CH(NH2)COOH.}}}
Метантиол применяется при синтезе пестицидов и фунгицидов.
Метантиол также применяется в качестве одорирующей добавки к природному газу, используемому в быту для обнаружения людьми аварийных утечек природного бытового газа по запаху.
Вхождение
Метантиол (MeSH) выделяется как побочный продукт при варке целлюлозы на целлюлозных заводах . При варке крафт-целлюлозы лигнин деполимеризуется путем нуклеофильной атаки с сильно нуклеофильным гидросульфид-ионом (HS — ) в сильно щелочной среде. Тем не менее, в побочной реакции, HS — атаки метоксильных групп (OMe) в лигнине , деметилирование , чтобы дать им бесплатно фенолят группам (PHO — ) и рилизинг меш. Из-за щелочности MeSH легко депротонируется ( MeSNa ), и образовавшийся ион MeS — также является сильным нуклеофилом, вступая в реакцию с диметилсульфидом . Соединения остаются в щелоке и сжигаются в котле-утилизаторе , где сера восстанавливается в виде сульфида натрия .
Метантиол высвобождается из разлагающихся органических веществ на болотах и присутствует в природном газе некоторых регионов, в каменноугольной смоле и в некоторых сырой нефти . Встречается в различных растениях и овощах, например в редисе.
В поверхностной морской воде метантиол является основным продуктом распада метаболита диметилсульфониопропионата водорослей (DMSP). Морские бактерии, по- видимому, получают большую часть серы в своих белках за счет расщепления DMSP и включения метантиола, несмотря на то, что метантиол присутствует в морской воде в гораздо более низких концентрациях, чем сульфат (~ 0,3 нМ против 28 мМ). Бактерии в окружающей среде как с кислородом, так и без него также могут превращать метантиол в диметилсульфид (ДМС), хотя большая часть ДМС в поверхностной морской воде образуется отдельным путем. И ДМС, и метантиол могут использоваться некоторыми микробами в качестве субстратов для метаногенеза в некоторых анаэробных почвах.
Метантиол — это побочный продукт метаболизма спаржи . Когда-то считалось, что образование метантиола в моче после употребления в пищу спаржи является генетическим признаком. Более поздние исследования показывают, что специфический запах на самом деле создается всеми людьми после употребления спаржи, в то время как способность обнаруживать его (метантиол является одним из многих компонентов «спаржевого моча») на самом деле является генетической чертой. Химические компоненты, ответственные за изменение запаха мочи, проявляются уже через 15 минут после употребления спаржи.
Протеиногенная аминокислота
Вместе с цистеин , метионин является одним из двух серы отработанных протеиногенных аминокислот . За исключением нескольких исключений, когда метионин может действовать как окислительно-восстановительный датчик (например,), остатки метионина не играют каталитической роли. Это контрастирует с остатками цистеина, где тиоловая группа играет каталитическую роль во многих белках. Однако тиоэфир играет второстепенную структурную роль из-за эффекта стабильности S / π-взаимодействий между атомом серы боковой цепи и ароматическими аминокислотами в одной трети всех известных белковых структур. Это отсутствие сильной роли отражено в экспериментах, где небольшой эффект наблюдается у белков, где метионин заменен норлейцином , аминокислотой с прямой углеводородной боковой цепью, в которой отсутствует тиоэфир. Было высказано предположение, что норлейцин присутствовал в ранних версиях генетического кода, но метионин вторгся в окончательную версию генетического кода из-за того, что он используется в кофакторе S- аденозилметионине (SAM). Эта ситуация не уникальна и могла произойти с орнитином и аргинином.
Кодирование
Метионин — одна из двух аминокислот, кодируемых одним кодоном (AUG) в стандартном генетическом коде ( другой — триптофан , кодируемый UGG). Отражая эволюционное происхождение его кодона, другие кодоны AUN кодируют изолейцин, который также является гидрофобной аминокислотой. В митохондриальном геноме нескольких организмов, включая метазоа и дрожжи , кодон AUA также кодирует метионин. В стандартном генетическом коде AUA кодирует изолейцин, а соответствующая тРНК ( ileX в Escherichia coli ) использует необычное основание лизидин (бактерии) или агматин (археи) для дискриминации AUG.
Кодон метионина AUG также является наиболее распространенным стартовым кодоном. «Стартовый» кодон — это сообщение для рибосомы, которое сигнализирует об инициации трансляции белка с мРНК, когда кодон AUG находится в консенсусной последовательности Козака . Как следствие, метионин часто включается в N-концевое положение белков у эукариот и архей во время трансляции, хотя он может быть удален с помощью посттрансляционной модификации . В бактериях в качестве исходной аминокислоты используется производное N- формилметионина .
Реакции
Подобно химии спиртов, тиолы образуют сульфиды , тиоацетали и тиоэфиры , которые аналогичны эфирам , ацеталам и сложным эфирам соответственно. Тиолы и спирты также сильно различаются по своей реакционной способности, тиолы окисляются легче, чем спирты. Тиолаты являются более сильными нуклеофилами, чем соответствующие алкоксиды .
S -алкилирование
Тиолы, или более конкретно их сопряженные основания, легко алкилируются с образованием сульфидов:
- RSH + R′Br + B → RSR ′ + Br (B = основание)
Кислотность
Тиолы легко депротонируются. По сравнению со спиртами тиолы более кислые. Конъюгированное основание тиола называется тиолатом . Бутантиола имеет р К а , 10,5 против 15 для бутанола. Тиофенол имеет p K a 6, по сравнению с 10 для фенола . Сильнокислый тиол представляет собой пентафтортиофенол (C 6 F 5 SH) с ap K a 2,68. Таким образом, тиолаты могут быть получены из тиолов обработкой гидроксидами щелочных металлов.
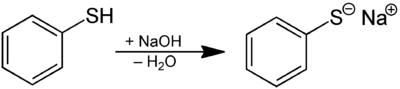
Синтез тиофенолята из тиофенола
Редокс
Тиолы, особенно в присутствии основания, легко окисляются реагентами, такими как бром и йод, с образованием органического дисульфида (R-S-S-R).
- 2 R − SH + Br 2 → R − S − S − R + 2 HBr
Окисление более мощными реагентами, такими как гипохлорит натрия или перекись водорода, также может давать сульфоновые кислоты (RSO 3 H).
- R-SH + 3 H 2 O 2 → RSO 3 H + 3 H 2 O
Окисление также может осуществляться кислородом в присутствии катализаторов:
- 2 R-SH + 1 / 2 O 2 → RS-SR + Н 2 О
Тиолы участвуют в тиол-дисульфидном обмене:
- RS-SR + 2 R’SH → 2 RSH + R’S-SR ‘
Эта реакция важна по своей природе.
Комплексообразование с ионами металлов
С ионами металлов тиолаты действуют как лиганды, образуя тиолатные комплексы переходных металлов . Термин меркаптан происходит от латинского mercurium captans (улавливающий ртуть), потому что тиолатная группа так прочно связывается с соединениями ртути . Согласно теории жесткой / мягкой кислоты / основания (HSAB) , сера является относительно мягким (поляризуемым) атомом. Это объясняет тенденцию тиолов связываться с мягкими элементами и ионами, такими как ртуть, свинец или кадмий. Стабильность тиолатов металлов сопоставима со стабильностью соответствующих сульфидных минералов.
Справочная информация
ДокументыЗаконыИзвещенияУтверждения документовДоговораЗапросы предложенийТехнические заданияПланы развитияДокументоведениеАналитикаМероприятияКонкурсыИтогиАдминистрации городовПриказыКонтрактыВыполнение работПротоколы рассмотрения заявокАукционыПроектыПротоколыБюджетные организацииМуниципалитетыРайоныОбразованияПрограммыОтчетыпо упоминаниямДокументная базаЦенные бумагиПоложенияФинансовые документыПостановленияРубрикатор по темамФинансыгорода Российской Федерациирегионыпо точным датамРегламентыТерминыНаучная терминологияФинансоваяЭкономическаяВремяДаты2015 год2016 годДокументы в финансовой сферев инвестиционной
3.3 Получение тиоэфиров:
4.
Взаимодействие
алкилгалогенидов с ксантогенатамищелочных
металлов
(Л.А. Чугаев):
5.
Промышленные
методы.
В промышленности
низшие
тиолы получают взаимодействием спиртовсH2S
в присутствии катализаторовпри 300–350 °С. Третичные алкантиолыC8
– C16
– взаимодействием непредельных
углеводородовсH2S
в присутствии А12О3
при 100–135 °С и давлении3,5–7 МПа.
Физические
свойства и строение.
Тиолы
представляют собой бесцветные соединения
с чрезвычайно неприятным запахом,
которым обнаруживается уже в ничтожных
концентрациях. Алкантиолы содержатся
в кишечных газах человека и животных,
в зловонных выделениях некоторых
животных.
АтомS
в меркаптогруппе имеет гибридизацию,
промежуточную междуsp2
и sp3.
Например, для молекулы СН3SН:
-
длины связей С–S
0,1817 нм, S–H
0,1329 нм; -
валентный угол
CSH
= 96,5°; -
энергия связи S–H
360 кДж/моль.
Потенциал
ионизациидляCH3SH
– 9,44 эВ
с
удлинением углеродной цепи понижается.
Электронная система атома серы значительно
подвижнее, чем кислоррода, что отражается
и на энергии ионизации. Тиолы являются
более сильными электронодонорами. В
молекулах тиолов угол CSH
равен 100–104°, что меньше, чем угол СОН
в алканолах. Для тиолов характерна
линейная зависимость термодинамических
величин от молекулярной массы (таблица
17).
Таблица
17 – Энергия
диссоциациисвязиС–SH
в тиолах
|
Соединение |
Eдис., |
|
CH3SH |
293,3 |
|
C2H5SH |
289,1 |
|
C3H7SH |
284,9 |
|
C4H9SH |
272,35 |
Группа
SH
обладает слабым –
I
и +M
эффектами, кислотные свойства ее
выше, а основные ниже, чем группыОН.
Связь
S–Н
менее полярна, чем связь О–Н,
поэтому у тиолов слабее межмолекулярные
водородные связи и ниже температуры
кипения, чем у соответствующих кислородных
аналогов (таблица 18).
Таблица
18 – Физические свойства некоторых
тиолов
|
Соединение |
Мr |
Тпл., |
Ткип., |
d420 |
nD20 |
|
Метантиол |
48.11 |
–123,02 |
6,02 |
0,8665 |
– |
|
Этантиол |
62,13 |
–144,40 |
35,00 |
0,8391 |
1,4310 |
|
Пропантиол |
76.16 |
–113,30 |
67,60 |
0,8411 |
1,4380 |
|
2—Пропантиол |
76,16 |
–130,54 |
52,56 |
0,8143 |
1.4255 |
|
Бутантиол |
90,19 |
–116,00 |
98,58 |
0,8416 |
1,4429 |
|
2—Метилпропантиол |
90,19 |
–140,20 |
85,15 |
0,8295 |
1,4366 |
|
Пентантиол |
104,22 |
–75,70 |
126,64 |
0,8421 |
1,4469 |
|
Циклогексантиол |
116,17 |
– |
158,0 |
0,9782 |
1,4921 |
|
Октантиол |
146,29 |
–49,20 |
77–78 |
0,8433 |
1,4540 |
|
2—Метил—2—пропантиол |
90,19 |
1,11 |
64,22 |
0.8002 |
1,4332 |
В
разбавленных растворах тиолы существуют
в виде мономеров, а в более концентрированных
– в виде димеров преимущественно
линейного строения благодаря образованию
водородных
связейS–H…S.
В жидком и твердом состоянии тиолы могут
образовывать полимеры.
Химические
свойства
1. Кислотные
свойства.
Тиолы более сильные кислоты, чем
соответствующие спирты (рК
этантиола –10,5, а этанола –18). Легкая
поляризуемость атома серы, вследствие
большего атомного радиуса и меньшей
электроотрицательностью по сравнению
с атомом кислорода, способствует
делокализации отрицательного заряда,
образующегося алкилсульфид-иона RS–
и, следовательно, повышает его стабильность.
1.1 Образование
солей.
Тиолы образуют растворимые в воде соли
тиоляты – с щелочными металлами и
нерастворимые – с тяжелыми металлами
(ртутью, свинцом, цинком). Это свойство
тиолов нашло свое отражение в названии
меркаптаны (от лат. mercuriuscaptans
– связывающий ртуть).
Способность тиолов
связывать ионы тяжелых металлов позволяет
использовать их как противоядия при
отравлениях соединениями мышьяка,
ртути, хрома, висмута.
Как нужно измерять концентрацию вредных элементов
Работодатель должен проводить контрольные мероприятия, направленные на выявление концентрации вредных элементов в воздухе. Обязанности по контролю несут сотрудники, ответственные за охрану труда в фирме.
Если на производстве присутствуют вредные элементы 1 класса опасности, контроль должен быть беспрерывным. Осуществляется он посредством самопишущих приборов. Последние подают сигнал при превышении ПДК. Однако приборы можно применить не во всех случаях. Иногда может осуществляться отбор проб воздуха с их последующим анализом. Пробы нужно брать в зоне дыхания сотрудника. Это 0,5 метра от лица работника. Отбор проводится не реже 5 раз за смену
Это высокая частота, однако это важно при производстве с повышенной опасностью
Если в воздухе присутствует несколько элементов однонаправленного действия, сумма их концентраций должна составлять не более 1. Рассмотрим примеры веществ с однонаправленным действием:
- Фтористый водород и соли фтористоводородной кислоты.
- Разные формы спиртов.
- Сернистый и серный ангидрид.
- Разные формы кислот.
- Формальдегид и соляная кислота.
- Разные виды ароматических углеводородов.
- Бромистый метил и сероуглерод.
Если в воздухе присутствуют вредные вещества, которые не отличаются однонаправленным действием, рассчитывается объем воздуха при установлении вентиляции. При расчетах за единицу нужно брать вредное вещество, предполагающее подачу наибольшего объема воздуха.
При расчете ПДК применяется эта информация:
- Токсичность и степень негативного влияния при одноразовом контакте с веществом.
- Условия появления токсичных элементов.
- Об агрегатном состоянии вещества.
- Химическое строение, физические характеристики.
Все предприятия, в работе которых участвуют вредные элементы, должны снизить их содержание в воздухе до минимума. Для этого создаются и внедряются новые технологии и организуются сопутствующие мероприятия.
Дополнительные принадлежности (по отдельному заказу):
- ЭХД для замены выработавших свой ресурс;
- вентиль точной регулировки ИБЯЛ.306577.002-05;
- индикатор расхода ИБЯЛ.418622.003-05;
- генератор ГДП-102 ИБЯЛ.413142.002;
- источник микропотока H2S«ИМ03-М-А2»;
- источник микропотока SO2 «ИМ05-М-А2»;
- источник микропотока Cl2 «ИМ09-М-А2»;
- источникмикропотока NО2«ИМ0О-0-Г1»;
- источник микропотока HCl «ИМ108-М-Е1»;
- источникмикропотокаС2Н2SH«ИМ07-М-А2»;
- баллонысПГС;
- комплект пополнения ИБЯЛ.305659.012(фильтр для защиты от пыли);
- кабельный ввод в упаковке ИБЯЛ.305649.048 (для ДАХ-М-05/-06);
- стилус ИБЯЛ.413929.005;
- коммуникатор ИБЯЛ.467239.005.
Арт. номер производителя: ИБЯЛ.413412.005, ИБЯЛ.413412.005-02, ИБЯЛ.413412.005-03, ИБЯЛ.413412.005-04, ИБЯЛ.413412.005-05, ИБЯЛ.413412.005-06.