Меркаптан
Содержание:
- Применение
- Удаление — меркаптан
- Что такое метилмеркаптан, который стал источником неприятного запаха в Москве, и вреден ли он?
- Этилмеркаптан
- Структура и склеивание
- Причина
- Общая формула, номенклатура
- Бактериологическое загрязнение воздуха в помещении
- Ссылки
- меркаптан: основная информация о пестициде
- 3.3 Получение тиоэфиров:
- Радиация
- Применение[править | править код]
- Физические свойства
Применение
За счёт сильного неприятного запаха тиолы, в частности, этантиол, используются для добавления в природные газы, не имеющие запаха, для обнаружения утечки по запаху. Согласно правилам Ростехнадзора, запах этантиола в одорированном природном газе должен ощущаться обонянием человека при концентрации природного газа в воздухе не более 20 % об. от нижнего предела взрываемости.
За счёт лёгкого гомолитического разрыва S-H связи с образованием малоактивных тиильных радикалов тиолы используются как ингибиторы радикальных цепных реакций, в частности, процессов автоокисления и радикальной полимеризации:
-
- ROO⋅+R′SH → ROOH+R′S⋅{\displaystyle {\mathsf {ROO\cdot +R’SH\ \rightarrow \ ROOH+R’S\cdot }}}
-
- ∼MM⋅+R′SH → ∼MMH+R′S⋅{\displaystyle {\mathsf {\sim MM\cdot +R’SH\ \rightarrow \ \sim MMH+R’S\cdot }}}
-
- 2R′S⋅ → R′SSR′{\displaystyle {\mathsf {2R’S\cdot \ \rightarrow \ R’SSR’}}}
Удаление — меркаптан
Процесс удаления меркаптанов или других вредных сернистых соединений из крекинг-дестиллатов описал также Gray, ам.
Недостатком методов удаления меркаптанов окислением является частичное окисление ненасыщенных углеводородов и неуглеводородных примесей. Поэтому крекинг-продукты сильно осмоляются.
Технология процессов удаления меркаптанов идет двумл путями. Первый из них основан на переводе меркаптанов в дс-сульфиды, что, с одной стороны, сообщает бензину приятный запах, а с другой — позволяет переводить активные сернистые соединения в нейтральные.
Отсутствием простых методов удаления меркаптанов любого химического строения достаточно эффективных и лишенных указанных выше недостатков объясняется появление в печати многочисленных новых патентов, описывающих пути обработки углеводородных фракций с целью извлечения меркаптанов или перевода их в неактивные сернистые соединения.
Поэтому при очистке нефтепродуктов удалению меркаптанов следует уделять особое внимание не только из-за их коррозионных свойств, но также из-за того, что они вызывают смолообразование в крекинг-бензинах. Это нужно особенно учитывать при производстве крекинг-бензинов из сернистого сырья.
|
Схема процесса Бендера.| Схема процесса Мерокс. |
Процесс Мерокс применяется преимущественно для удаления меркаптанов из бензинов. Окисление меркаптанов в дисульфиды проводится кислородом воздуха при обычной температуре в присутствии хелатных соединений металлов в качестве катализатора.
|
Схема процесса гидродесульфурации. |
Очистка от активной серы ( удаление меркаптана) осуществляет обработку сернистых соединений ( сероводород, тио-фен и меркаптан) с целью улучшения цвета, запаха и устойчивости к окислению и уменьшения концентраций двуокиси углерода в бензине.
Выше мы видели, что удаление меркаптанов раствором едкого натра не достигает своей цели, вследствие обратимости реакции и слабости течения ее с высокомолекулярными меркаптанами. Поэтому с целью радикального уничтожения, присутствия меркаптанов прибегают к плумбитной очистке. Несм рря на то, что процессы плумбитной очистки бензинов применяются на практике давно, химизм очистки остается во многом спорным.
|
Схема процесса Бендера.| Схема процесса Мерокс. |
Процесс Мерокс применяется преимущественно для удаления меркаптанов из бензинов. Окисление меркаптанов в дисульфиды проводится кислородом воздуха при обычной температуре в присутствии хелатных соединений металлов в качестве катализатора.
|
Распределение бициклических ( 7 и трициклических ( 2 ароматических соединений по фракциям дистиллята.| Распределение серы по фракциям дистиллята. |
Впоследствии было выяснено, что удаление меркаптанов путем селективной экстракции фенолом связано с применением значительных количеств растворителя ( около 200 % объемн. В то же время количество меркаптанов резко сокращается под воздействием небольших количеств ( 1 5 — 2 %) серной кислоты.
Наибольшие трудности возникают с проблемой удаления меркаптанов.
Что такое метилмеркаптан, который стал источником неприятного запаха в Москве, и вреден ли он?
8 декабря жители разных районов Москвы жаловались на сильный неприятный запах в воздухе, напоминающий запах гнилой квашеной капусты или сероводорода. Эксперты Роспотребнадзора произвели отбор проб атмосферного воздуха по 37 адресам Москвы в период с 8 по 10 декабря.
Всего было проведено более двух тысяч исследований, по итогам которых ведомство пришло к выводу, что причиной появления неприятных запахов, вероятнее всего, являлось вещество меркаптан. В пробах воздуха метилмеркаптан был обнаружен в количестве 0,3 предельно допустимой концентрации.
О том, что это за вещество, откуда могло появиться в воздухе и опасно ли для человека, «Таким делам» рассказали Владимир Чупров, руководитель энергетической программы Гринпис России, и заведующий отделом экологических и медицинских проблем Института общей физики им. А. М. Прохорова РАН Евгений Степанов.
Владимир Чупров:
Меркаптаны, они же тиолы, — это газы, сернистые аналоги спиртов. Даже при низкой концентрации они очень сильно пахнут. Их используют как маркер, добавляя в природный газ, не имеющий запаха, чтобы человек мог заметить утечку.
Метилмеркаптан нельзя назвать безопасным газом, но в концентрациях, не превышающих предельно допустимые (ПДК), он просто неприятен — напоминает запах гнилой капусты. Те, кто живет вблизи нефтегазовых производств, зачастую просто привыкают к нему.
Роспотребнадзор не выявил превышения ПДК типичных загрязнителей и меркаптанов в атмосферном воздухе Москвы, но причины для беспокойства все-таки имеются — ведь это газ-маркер. Нужно разбираться, где был выброс, хотя известно, что следов природного газа метана не выявлено. Отмечу, что помимо процесса гниения на свалках метилмеркаптан может также выделяться при производстве целлюлозы.
Евгений Степанов:
Показывает ли «Мосэкомониторинг» все честно — это вопрос. Нужно сравнивать все данные с предельно допустимыми концентрациями и смотреть, насколько далеко от источника загрязнений были взяты пробы. Передвижных станций недостаточно для того, чтобы определить место выброса вещества, это должны сделать с помощью мобильных лабораторий.
Тут есть такой тонкий момент: предельно допустимая концентрация — это группа понятий. Есть среднесуточная, многоразовая и рабочая зоны. Все эти величины разные. Самая критическая величина — среднесуточная, потому что если у вас в течение суток небольшое количество этого газа выделяется, а вы его вдыхаете три дня подряд, то накопительный эффект будет более существенный, чем разовый.
Разница между среднесуточной и многоразовой очень большая, и нужно четко понимать, какую предельно допустимую концентрацию они имели в виду. В этом и хитрость: они могут выдать многоразовую за среднесуточную, например, как им выгодно.
В сентябре «ТД» писали о том, что жители Подмосковья и Гринпис потребовали раскрыть данные о загрязнении воздуха и возобновить работу сайта «Мосэкомониторинга».
Портал был отключен после того, жители как юго-востока Москвы, Балашихи, Реутова и Люберец стали задыхаться от загрязненного воздуха. Однако представитель столичного департамента природопользования заверила горожан, что речь идет «просто о модернизации программного обеспечения и оперативной системы баз данных».
На основании имеющихся документов Гринпис России и более 12 тысяч людей, подписавших петицию, потребовали от властей возобновить публикацию оперативной и подробной информации о загрязнении воздуха.
Наталья Панова, Анастасия Коноплева
Этилмеркаптан
Этилмеркаптан — легколетучая жидкость, обладает сильным неприятным запахом, токсичен, действует на центральную нервную систему, вызывая судороги, паралич и смерть. Даже в ничтожных концентрациях его пары рефлекторно вызывают тошноту, головную боль из-за отвратительного запаха. Одним из продуктов его сгорания является сернистый газ, который не только ядовит, но и коррозионно активен
При одоризации газа персонал одоризационных установок должен быть тщательно проинструктирован и должен соблюдать особые меры предосторожности при работе с ним. Переливать жидкий этилмеркаптан необходимо закрытым способом.
Этилмеркаптан частично растворим в воде, хорошо растворим в спирте, эфире, бензоле, нефти и газовом конденсате. Этилмеркаптан хранится в герметично закрытых бочках в специальных складских помещениях или под навесом вне воздействия солнечных лучей.
Этилмеркаптан взаимодействует с железом и его окислами, образуя склонные к самовозгоранию меркаптиды железа. Установлены факты самовоспламенения пирофорных отложений при — 20 С. Эти отложения состоят в основном из сернистого железа. Медленное воздействие кислорода на пирофорные отложения приводит к постепенному их окислению с выделением элементарной серы, заполняющей поры и покрывающей отложения защитной пленкой.
Этилмеркаптан и более высокомолекулярные гомологи — жидкости, нерастворимые в воде.
Этилмеркаптан производят путем синтеза из этилового спирта и сероводорода: Ш8 С2ШОН — CiHsSH ШО.
Этилмеркаптан свинца, Pb ( SC2Hs) 2 — желтое соединение, плавящееся при 150 и растворимое в хлороформе и бензоле.
Определение этилмеркаптана и образовавшегося из диметил-дисульфида метилмеркаптана производят следующим образом. Из первого поглотительного прибора отбирают для анализа 1 и 5 мл, а из второго — полный объем пробы, доводят недостающий объем до 5 мл раствором ацетата ртути, вносят по 0 5 мл составного реактива и перемешивают.
Производство этилмеркаптанов из хлористого этила было проведено в широком масштабе. Этилмеркаптан применяется в качестве исходного продукта при синтезе сульфонала, весьма распространенного снотворного средства.
Запах этилмеркаптана ощущается при содержании 0 19 г ( 0 22 мл) в 1000 м3 воздуха. Расход жидкого одоранта следует принимать из расчета 1 л на 500 — 20 000 м3 воздуха или инертного газа.
Концентрация этилмеркаптана должна составлять 16 г на 1000 м3 природного газа.
Десорбция этилмеркаптана производится отдув ко и паром при кипячении ( аналогично процессу регенерации моноэтаноламина, см. главу IV) или каким-либо газом при нагревании. Регенерация может проводиться в насадочных аппаратах, однако керамические кольца не выдерживают условий процесса и быстро разрушаются.
Расход этилмеркаптана для одоризации топливного и пускового газа в среднем равен 16 г на 1000 м3 газа.
Поведение этилмеркаптана отлично от поведения высших тиолов. Так, при встряхивании этилмеркаптана с эквимолекулярным количеством ацетата ртути получается неполный меркаптид состава C2H5SHgCl вместо полного меркаптида R — S — Hg — S — R, образующегося в случае других меркаптанов. Формула и температура плавления совпадают с литературными данными. При реакции этилмеркаптана с большим избытком насыщенного раствора сулемы получается комплекс неполного меркацтида ртути С2Н5 — S — HgCl HgCh, что соответствует данным других авторов.
|
Синтез этилмеркаптана реакцией ацетилена с сероводородом при атмосферном давлении в среде ГМФТА.| Периодический синтез ДВС из ацетилена и сероводорода в 5-литровом реакторе. |
Вынос этилмеркаптана в ловушку наблюдается только после полного превращения щелочи в гидросульфид щелочного металла, что доказано потенциометрическим титрование. По-видимому, здесь реализуется схема , представленная выше. Вероятно, этим и объясняется в данном случае его специфически ускоряющее воздействие на окислительно-восстановительные процессы.
Структура и склеивание
Тиолы структуры R-SH называются алкантиолами или алкилтиолами, в которых алкильная группа (R) присоединена к сульфгидрильной группе (SH). Тиолы и спирты имеют аналогичную связь. Поскольку сера является более крупным элементом, чем кислород, длина связи C-S — обычно около 180 пикометров — примерно на 40 пикометров длиннее типичной связи C-O. Углы C-S-H приближаются к 90 °, тогда как угол для группы C-O-H более тупой. В твердом или жидком состоянии водородная связь между отдельными тиоловыми группами слабая, основная сила сцепления — ван-дер-ваальсовы взаимодействия между центрами двухвалентной серы с высокой поляризацией.
Связь S-H намного слабее, чем связь O-H, что отражено в их соответствующей энергии диссоциации связи (BDE). Для CH 3 S-H БДЭ составляет 366 кДж / моль (87 ккал / моль), а для CH 3 O-H БДЭ составляет 440 кДж / моль (110 ккал / моль).
Из-за небольшой разницы в электроотрицательности серы и водорода связь S − H является умеренно полярной . Напротив, связи O-H в гидроксильных группах более полярны. Тиолы имеют более низкий дипольный момент по сравнению с соответствующими спиртами.
Причина
Кишечный газ состоит из различных количеств экзогенных и эндогенных источников. Экзогенные газы заглатываются ( аэрофагия ) во время еды или питья или учащенного глотания во время чрезмерного слюноотделения (что может происходить при тошноте или в результате гастроэзофагеальной рефлюксной болезни). Эти эндогенные газы получают либо в качестве побочного продукта переваривания определенных видов пищи, или неполного пищеварения , как это имеет место во время стеатореи . Все , что вызывает пищу быть не полностью переварено желудком или тонкой кишкой , может вызвать метеоризм , когда материал поступает в толстой кишке, в результате ферментации с помощью дрожжей или прокариота нормально или ненормально присутствует в желудочно — кишечном тракте .
Продукты, вызывающие метеоризм, обычно содержат много определенных полисахаридов , особенно олигосахаридов, таких как инулин . Эти продукты включают бобы , чечевицу , молочные продукты , лук , чеснок , зеленый лук , лук-порей , репу , шведку , редис , сладкий картофель , картофель , кешью , топинамбур , овес , пшеницу и дрожжи в хлебе . Цветная капуста , брокколи , капуста , брюссельская капуста и другие крестоцветные овощи , принадлежащие к роду Brassica , обычно считаются не только способствующими вздутию живота, но и их остротой.
В бобах эндогенные газы, по-видимому, возникают из сложных олигосахаридов ( углеводов ), которые особенно устойчивы к перевариванию млекопитающими, но легко усваиваются кишечной флорой — микроорганизмами ( метанопродуцирующими архей; Methanobrevibacter smithii ), которые населяют пищеварительный тракт . Эти олигосахариды проходят через верхнюю часть кишечника в основном в неизменном виде, а когда они достигают нижней части кишечника, бактерии питаются ими, производя обильное количество газов.
Избыточные газы или газы с неприятным запахом могут быть признаком нарушения здоровья, такого как синдром раздраженного кишечника , целиакия , непереносимость глютена или непереносимость лактозы . Это также может быть вызвано некоторыми лекарствами, такими как ибупрофен , слабительные , противогрибковые препараты или статины . Некоторые инфекции, например лямблиоз , также связаны с метеоризмом.
Интерес к причинам метеоризма был подстегнут высотными полетами и полетами человека в космос ; низкое атмосферное давление , стесненные условия и стрессы, свойственные этим усилиям, вызывали беспокойство. В области альпинизма явление высотного выброса газов было впервые зарегистрировано более двухсот лет назад.
Общая формула, номенклатура
Тиолы (меркаптаны) — это органические соединения, являющиеся сернистыми аналогами спиртов. Общая формула $RSH$, где $R$- углеводородный радикал. Например, $C_2H_5SH$ — этантиол (этилмеркаптан).
Сульфиды — это органические соединения, являющиеся сернистыми аналогами простых эфиров. Общая формула $R^1SR^2$.
Тиолы и сульфиды можно представить как производные сероводорода, в котором атомы водорода замещены органическими радикалами.
Согласно номенклатуре IUPAC, тиолы имеют окончание — тиол:
Рисунок 1. 2-метил-1-бутантиол. Автор24 — интернет-биржа студенческих работ
Рисунок 2. 3-пентантиол. Автор24 — интернет-биржа студенческих работ
Рисунок 3. Циклогексантиол. Автор24 — интернет-биржа студенческих работ
Названия сульфидов строятся аналогично названиям простых эфиров: перед окончанием сульфид даются названия алкильных или арильных групп:
$C_6H_5SC_6H_5$ — дифенилсульфид, $CH_3-S-CH_2CH_2CH_3$ — метилпропилсульфид.
Согласно номенклатуре IUPAC сульфиды называются алкилтиоалканами. Главной цепи алкана дает название большая из алкильных групп:
Рисунок 4. 3-метил-(1-метилтио)пентан. Автор24 — интернет-биржа студенческих работ
Рисунок 5. 1-(изопропилтио)пентан. Автор24 — интернет-биржа студенческих работ
В простых случаях для названий сульфидов пользуются общей номенклатурой, согласно которой их называют диалкил-(арил)сульфидами.
Бактериологическое загрязнение воздуха в помещении
В воздухе помещений находится огромное число микроорганизмов, большая часть которых задерживается в легких человека, что может привести к различным заболеваниям. Находящиеся в воздухе микроскопические живые организмы (например, вирусы, споры грибов и клетки бактерий) обнаруживаются во всех помещениях. Эти организмы присутствуют в воздухе в виде мелких частиц. Известно огромное количество различных видов плесени и бактерий.
Бактерии
-
Легионелла — интенсивно размножается на синтетических и резиновых поверхностях водопроводного, промышленного, медицинского оборудования, где они очень устойчивы к действию дезинфицирующих веществ. Наиболее благоприятной средой обитания легионеллы являются системы кондиционирования и вентиляции.
Легионеллез (болезнь легионеров) — острая инфекционная болезнь, вызываемая легионеллами; характеризуется лихорадкой, выраженной общей интоксикацией, поражением легких, ЦНС, органов пищеварения, возможен летальный исход. Чаще заболевают лица среднего и пожилого возраста; заболеванию способствуют курение, употребление алкоголя, сахарный диабет, применение иммунодепрессантов.
-
Сальмонелла — род кишечных палочковидных бактерий. Многие патогенны — возбудители брюшного тифа.
Сальмонеллез — это заболевание, вызываемое микроорганизмами из рода сальмонелл. Заболевание сальмонеллезом чаще возникает в результате употребления зараженных возбудителями мяса и мясных продуктов. Кроме того, сальмонеллы могут попадать в пищу при использовании загрязненной воды и посуды.Попадание возбудителей сальмонеллеза в организм человека вызывает повышение температуры, озноб, боли в животе.
Плесень
-
Плесень — распространяется по воздуху в виде микроскопических спор. Плесневые грибы активно размножаются при комнатной температуре в условиях повышенной влажности и неэффективной вентиляции на многих материалах и покрытиях, используемых внутри помещении, включая бетон, штукатурку, дерево, пластики, резину, окрашенные поверхности, и т.д.
Неблагоприятное воздействие плесени на организм человека проявляется в головокружении, головных болях, трудно диагностируемых и поддающихся лечению аллергических заболеваниях кожи и дыхательных путей. Следует отметить, что подвержены опасности заболеваний прежде всего дети, пожилые люди и люди с ослабленным иммунитетом.
- Аспергилл — род плесневых грибов. Существует около 160 видов аспергилл. Многие аспергиллы образуют плесени (зеленые, черные) на пищевых продуктах, вызывают разрушение промышленных изделий (ткани, кожи, пластмассы), ускоряют коррозию металлов.
Аспергиллез — заболевание, вызываемое грибами рода Aspergillus. К заболеванию ведет вдыхание большого количества спор аспергилл.
Для аллергического бронхиального аспергиллеза характерны лихорадка, сильный кашель; течение может быть длительным с повторными обострениями и развитием тяжелой бронхиальной астмы.
Ссылки
Примечания
Библиография
- Аллен В. (2007) О пердеже: язык и смех в средние века. Пэлгрейв Макмиллан. ISBN 978-0-312-23493-5 .
- Болин, Т.Д. и Стэнтон, Р. (1997). Ветер ломается . Аллен и Анвин. ISBN 978-1-86448-321-5.
- Доусон, Джим (1999). Кто разрезал сыр?: Культурная история пердуна . Десятискоростной пресс. ISBN 1-58008-011-1.
- Доусон, Джим (2006). Во всем виновата собака: современная история пердуна . Десятискоростной пресс. ISBN 1-58008-751-5.
- Франклин, Бенджамин (2003). Japikse, Карл (ред.). Fart Proudly ((Перепечатка) изд.) ООО «Лягушка» / Blue Snake. ISBN 1-58394-079-0.
- Перселс, Дж. И Ганим, Р. (2004) Фекальные вопросы в ранней современной литературе и искусстве: исследования по скатологии . (Глава 1: Благородное искусство пердежа в эпоху континентального Возрождения). ISBN 0-7546-4116-3 .
- фон Шмаузен, Д. (2002). Официальные правила, Международный чемпионат New World Odor по фристайлу . LULU. ISBN .
меркаптан: основная информация о пестициде
Описание: Продукт преобразования пестицида
Год официальной регистрации: —
Выпуск пестицидов на рынок (директива 91/414/ЕЭС), статус:
| Статус | Не определяется |
| Досье докладчика / содокладчика | Не определяется |
| Дата включения истекает | Не определяется |
Разрешен к применению (V) или известен (#) в следующих Европейских странах:
Основные сведения:
| Тип пестицида | Метаболит |
| Тип метаболита | почва |
| Группа по химическому строению | Не классифицирован |
| Характер действия | Не применимый |
| Регистрационный номер CAS | 74-93-1 |
| Шифр КФ (Код Фермента) | 200-822-1 |
| Шифр Международного совместного аналитического совета по пестицидам (CIPAC) | — |
| Химический код Агентства по охране окружающей среды США (US EPA) | Не определяется |
| Химическая формула | CH4S |
| SMILES | SC |
| Международный химический идентификатор (InChI) | InChI=1/CH4S/c1-2/h2H,1H3 |
| Структурная формула | 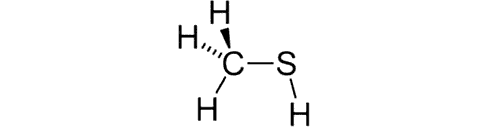 |
| Молекулярная масса (г/моль) | 48.10 |
| Название по ИЮПАК | methylmercaptan |
| Название по CAS | methyl mercaptan |
| Другая информация | Marine Pollutant |
| Устойчивость к гербициду по HRAC | Не определяется |
| Устойчивость к инсектициду по IRAC | Не определяется |
| Устойчивость к фунгициду по FRAC | Не определяется |
| Физическое состояние | Бесцветное газовое обоняние гниющей капустой |
Может быть продуктом:
| Исходное вещество | Среда образования | Расчетный максимум рапространения фракции | Соответствие директиве 91/414 |
| vernolate | почва | — |
Выпуск:
| Производители пестицида | |
| Коммерческие названия препаратов, содержащих д.в. | — |
| С этим веществом связаны: | — |
| Оценка риска от пестицида для местной экологии (Англия) | Не определяется |
| Препаративная форма и особенности применения | — |
3.3 Получение тиоэфиров:
4.
Взаимодействие
алкилгалогенидов с ксантогенатамищелочных
металлов
(Л.А. Чугаев):
5.
Промышленные
методы.
В промышленности
низшие
тиолы получают взаимодействием спиртовсH2S
в присутствии катализаторовпри 300–350 °С. Третичные алкантиолыC8
– C16
– взаимодействием непредельных
углеводородовсH2S
в присутствии А12О3
при 100–135 °С и давлении3,5–7 МПа.
Физические
свойства и строение.
Тиолы
представляют собой бесцветные соединения
с чрезвычайно неприятным запахом,
которым обнаруживается уже в ничтожных
концентрациях. Алкантиолы содержатся
в кишечных газах человека и животных,
в зловонных выделениях некоторых
животных.
АтомS
в меркаптогруппе имеет гибридизацию,
промежуточную междуsp2
и sp3.
Например, для молекулы СН3SН:
-
длины связей С–S
0,1817 нм, S–H
0,1329 нм; -
валентный угол
CSH
= 96,5°; -
энергия связи S–H
360 кДж/моль.
Потенциал
ионизациидляCH3SH
– 9,44 эВ
с
удлинением углеродной цепи понижается.
Электронная система атома серы значительно
подвижнее, чем кислоррода, что отражается
и на энергии ионизации. Тиолы являются
более сильными электронодонорами. В
молекулах тиолов угол CSH
равен 100–104°, что меньше, чем угол СОН
в алканолах. Для тиолов характерна
линейная зависимость термодинамических
величин от молекулярной массы (таблица
17).
Таблица
17 – Энергия
диссоциациисвязиС–SH
в тиолах
|
Соединение |
Eдис., |
|
CH3SH |
293,3 |
|
C2H5SH |
289,1 |
|
C3H7SH |
284,9 |
|
C4H9SH |
272,35 |
Группа
SH
обладает слабым –
I
и +M
эффектами, кислотные свойства ее
выше, а основные ниже, чем группыОН.
Связь
S–Н
менее полярна, чем связь О–Н,
поэтому у тиолов слабее межмолекулярные
водородные связи и ниже температуры
кипения, чем у соответствующих кислородных
аналогов (таблица 18).
Таблица
18 – Физические свойства некоторых
тиолов
|
Соединение |
Мr |
Тпл., |
Ткип., |
d420 |
nD20 |
|
Метантиол |
48.11 |
–123,02 |
6,02 |
0,8665 |
– |
|
Этантиол |
62,13 |
–144,40 |
35,00 |
0,8391 |
1,4310 |
|
Пропантиол |
76.16 |
–113,30 |
67,60 |
0,8411 |
1,4380 |
|
2—Пропантиол |
76,16 |
–130,54 |
52,56 |
0,8143 |
1.4255 |
|
Бутантиол |
90,19 |
–116,00 |
98,58 |
0,8416 |
1,4429 |
|
2—Метилпропантиол |
90,19 |
–140,20 |
85,15 |
0,8295 |
1,4366 |
|
Пентантиол |
104,22 |
–75,70 |
126,64 |
0,8421 |
1,4469 |
|
Циклогексантиол |
116,17 |
– |
158,0 |
0,9782 |
1,4921 |
|
Октантиол |
146,29 |
–49,20 |
77–78 |
0,8433 |
1,4540 |
|
2—Метил—2—пропантиол |
90,19 |
1,11 |
64,22 |
0.8002 |
1,4332 |
В
разбавленных растворах тиолы существуют
в виде мономеров, а в более концентрированных
– в виде димеров преимущественно
линейного строения благодаря образованию
водородных
связейS–H…S.
В жидком и твердом состоянии тиолы могут
образовывать полимеры.
Химические
свойства
1. Кислотные
свойства.
Тиолы более сильные кислоты, чем
соответствующие спирты (рК
этантиола –10,5, а этанола –18). Легкая
поляризуемость атома серы, вследствие
большего атомного радиуса и меньшей
электроотрицательностью по сравнению
с атомом кислорода, способствует
делокализации отрицательного заряда,
образующегося алкилсульфид-иона RS–
и, следовательно, повышает его стабильность.
1.1 Образование
солей.
Тиолы образуют растворимые в воде соли
тиоляты – с щелочными металлами и
нерастворимые – с тяжелыми металлами
(ртутью, свинцом, цинком). Это свойство
тиолов нашло свое отражение в названии
меркаптаны (от лат. mercuriuscaptans
– связывающий ртуть).
Способность тиолов
связывать ионы тяжелых металлов позволяет
использовать их как противоядия при
отравлениях соединениями мышьяка,
ртути, хрома, висмута.
Радиация
Общая доза облучения человека, складывается из естественного радиационного фона и облучения локальными источниками радиации. Сумма двух этих составляющих зачастую может оказывать вредное воздействие на организм человека.
Локальными источниками радиации в помещениях и на улице могут быть:
стены домов из бетона, шлакоблоков и полимербетона;
гранит, мрамор, пемза;
кирпич. Основным компонентом кирпича является глина, которая является естественным источником излучения;
сантехника;
кафель, гипсокартон;
будильники и наручные часы, изготовленные в 60-е годы прошлого века. Стрелки таких часов часто пропитывались светящимися составами постоянного действия. Сначала они делались на основе безобидного фосфора, а вот в 50-60-е годы стали использовать специальный радиолюминесцентный состав, содержащий изотопы трития. Таким же составом покрывали шкалу измерений и во многих других приборах, например, в барометрах, термометрах, квартирных счетчиках электроэнергии, бытовых вольтметрах и так далее. Долгое нахождение в одном помещении с этими источниками может привести к возникновению раковых опухолей и даже лучевой болезни, поскольку подобные приборы излучают радиацию до 20 тыс. микрорентген в час;
продукты питания. Ежегодно специалисты НПО «Радон» изымают около полутора тонн радиоактивных продуктов, например, овощи, фрукты, грибы с цезием-137 или стронцием-90;
специалисты утверждают, что бытовая техника радиации не излучает. За исключением разве что телевизора, но действие этой радиации до конца пока не изучено
Ученые считают, что излучаемый телевизором фон находится в пределах нормы, но в целях предосторожности исследователи рекомендуют находиться по возможности, как можно дальше от включенного телеэкрана.
Влияние радиации на здоровье
Существуют значительные различия в радиочувтвительности у разных людей. Известно, например, что дети и пожилые люди в большей степени подвержены воздействию радиации. Это зависит от количества (дозы) радиации, которое получил человек, от типа и от того, сколько времени человек провёл в зоне воздействия.
- онкологические заболевания проявляются спустя много лет после облучения, как правило, не ранее, чем через 5-10 лет.
- повреждения генетического аппарата, плачевные результаты проявляются лишь в следующем или последующих поколениях.
Применение[править | править код]
Метантиол используется в производстве аминокислоты метионина, использующейся в качестве кормовой добавки, из акролеина H2C=CH−CHO{\displaystyle {\ce {H2C=CH-CHO}}}.
На первой стадии присоединением метантиола к акролеину синтезируют 3-метилтиопропионовый альдегид:
- CH3SH+H2C=CH−CHO⟶CH3SCH2CH2CHO,{\displaystyle {\ce {CH3SH + H2C=CH-CHO -> CH3SCH2CH2CHO,}}}
который далее используется в качестве карбонильного компонента в синтезе Штреккера:
- CH3SCH2CH2CHO+HCN+NH3⟶CH3SCH2CH2CH(NH2)CN;{\displaystyle {\ce {CH3SCH2CH2CHO + HCN + NH3 -> CH3SCH2CH2CH(NH2)CN;}}}
- CH3SCH2CH2CH(NH2)CN+H2O⟶CH3SCH2CH2CH(NH2)COOH⋅{\displaystyle {\ce {CH3SCH2CH2CH(NH2)CN + H2O -> CH3SCH2CH2CH(NH2)COOH.}}}
Метантиол применяется при синтезе пестицидов и фунгицидов.
Метантиол также применяется в качестве одорирующей добавки к природному газу, используемому в быту для обнаружения людьми аварийных утечек природного бытового газа по запаху.
Физические свойства
Полярность связи S−H{\displaystyle {\ce {S-H}}} значительно ниже, чем полярность связи O-H, в результате водородные связи между молекулами тиолов значительно слабее, чем у спиртов, и вследствие этого их температура кипения ниже, чем у соответствующих спиртов.
|
|
|
|
|
|
|
|
H-OH(H2O) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тиолы малорастворимы в воде, но хорошо растворяются в этаноле, диэтиловом эфире и других органических растворителях.
Низшие алифатические тиолы являются легколетучими жидкостями с отвратительным запахом, причём их запах ощущается обонянием человека в чрезвычайно низких концентрациях — 10−7−10−8 моль/л. Это свойство используется для одорирования природного бытового газа, не имеющего запаха — добавка летучих тиолов к газу позволяет обнаруживать людям утечки газа в помещениях, по запаху.