Отравление хлорпикрином
Содержание:
- Клиническая картина
- УПАКОВКА, МАРКИРОВКА, ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ
- Химические и физические свойства ВВ
- Безопасность
- Использование в армии и мощность ВВ
- Создание тротила
- Хлорпикрин как боевое отравляющее вещество (ОВ)[ | код]
- Использует
- ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
- Общие «взрывные» качества
- Токсические свойства
- Общая характеристика
- Методы синтеза
- Аварийная карточка (АХОВ)
- Первая врачебная помощь
- структура
- ссылки
Клиническая картина
Выделяют несколько стадий поражения: рефлекторную (начальную), скрытый период, развитие токсического отека легких, разрешение отека и стадию отдаленных последствий.
Для начальной стадии характерны резь в глазах, ощущение саднения в горле и за грудиной, стеснение в груди, кашель, иногда тяжесть в эпигастральной области, тошнота, нередко — рвота.
Скрытый период может отсутствовать, но в среднем продолжается от 2 до 24 ч (в зависимости от тяжести поражения). Короткий скрытый период указывает на быстрое развитие отека легких, предопределяя тяжелую степень поражения. Состояние пораженных в этой стадии удовлетворительное, жалоб либо нет, либо отмечается небольшая общая слабость и одышка при физической нагрузке, иногда головная боль, тошнота. Существует ряд характерных признаков, позволяющих диагностировать поражение на этой стадии. Наиболее информативным является несоответствие между частотой дыхания и пульса: соотношение между ними вместо обычного 1:4 становится 1:2,5–1:2. Одновременно снижается пульсовое АД.
Стадия развития токсического отека легких характеризуется нарастанием одышки, цианозом, беспокойством пострадавшего. Перкуторный звук над легкими приобретает коробочный оттенок, экскурсия грудной клетки ограничена. При аускультации выявляется асимметрия дыхания — ослабление его на одной из сторон грудной клетки. Затем в нижних отделах (особенно в задних нижних) появляются мелкопузырчатые хрипы, число которых по мере развития отека увеличивается, а к концу первых суток они выслушиваются над всей поверхностью легких как сзади, так и спереди. В дальнейшем возникают среднеи крупнопузырчатые хрипы, дыхание становится клокочущим, отделяется серозная пенистая мокрота, иногда от примеси крови окрашенная в розовый цвет. Прогрессирует цианоз, нарастают клинические признаки гипоксии. В связи с перераспределением жидкости в организме отмечается гемоконцентрация (содержание гемоглобина доходит до 160–200 г/л, число эритроцитов — до 6–7×10 12 /л), что повышает ее вязкость, затрудняет деятельность системы кровообращения, способствуя циркуляторной гипоксии, повышению свертываемости крови и развитию тромбоэмболических осложнений. Такое состояние отравленного в стадии развившегося отека легких называется «синей гипоксией».
Дальнейшее прогрессивное ухудшение состояния связано с развитием острой сердечно-сосудистой недостаточности и формированием смешанной гипоксии. Лицо больного становится пепельно-серым, видимые слизистые оболочки приобретают своеобразный грязно-землистый оттенок. Характерны тахикардия, артериальная гипотензия (АД снижается ниже 90/60 мм рт.ст.), возможно угнетения сознания. Изменения газового состава крови усиливаются: нарастает гипоксемия, к ней присоединяется гипокапния. Падение содержания углекислоты в крови приводит к ослаблению стимуляции дыхательного и сосудодвигательного центров, вследствие чего снижается венозный тонус, уменьшается диссоциация оксигемоглобина, развивается коллапс. Такой симптомокомплекс носит название «серой гипоксии». Достигнув максимума к исходу первых суток, явления отека легких держатся на высоте процесса в течение двух суток. На этот период приходится 70–80% летальных исходов.
Стадия разрешения отека наступает, как правило, с 3-х суток и характеризуется регрессом клинических проявлений. При отсутствии осложнений длительность этой стадии равна 4–6 сут, однако осложнения возникают довольно часто, и продолжительность разрешения отека может растягиваться до 20 и более суток.
Осложнениями поражений пульмонотоксикантами являются пневмонии (нередко на фоне гнойно-деструктивных процессов в легочной ткани), вторичные кардиомиопатии, тромбозы сосудов (нижних конечностей, тазового сплетения, брыжейки) и тромбоэмболии.
УПАКОВКА, МАРКИРОВКА, ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ
4.1. Хлорпикрин упаковывают в бочки БСТ 1-1 110-4 по ГОСТ 17366. Бочки герметизируют прокладками из прокладочного поливинилхлоридного пластиката толщиной 2-3 см. Перед наполнением бочки испытывают на давление 0,39 МПа (4 кгс/см) водой и сушат горячим воздухом.Степень заполнения бочек вычисляют с учетом максимального использования вместимости тары и объемного расширения продукта при возможном перепаде температур в пути следования.(Измененная редакция, Изм. N 2).
4.2. Маркировка — по ГОСТ 14189 с нанесением знака опасности по ГОСТ 19433 (класс 6, подкласс 6.1, шифр группы 6111), серийный номер ООН 1580.Способ нанесения маркировки — непосредственно на тару по трафарету.(Измененная редакция, Изм. N 3).
4.3. Транспортирование — по ГОСТ 14189 транспортом всех видов, кроме воздушного.Высота штабелирования при морских перевозках — не более чем в три яруса.(Измененная редакция, Изм. N 2).
4.4. Хлорпикрин на экспорт упаковывают в новые бочки БСТ 1-1 110-4 по ГОСТ 17366, окрашенные в два слоя эмалью ГФ-1426 защитного цвета по ГОСТ 6745 или эмалью ПФ-223 стального цвета по ГОСТ 14923, или ПФ-115 серого цвета по ГОСТ 6465.Упаковывание проводят в соответствии с требованиями внешнеторгового объединения.Тара должна отвечать требованиям ГОСТ 26319.Бочки формируют в пакеты на плоских поддонах по ГОСТ 9557 в соответствии с требованиями ГОСТ 21929, ГОСТ 21650 и ГОСТ 24597.(Измененная редакция, Изм. N 2, 3).
4.5. Хранение — по ГОСТ 14189 в упаковке изготовителя.(Измененная редакция, Изм. N 2).
Химические и физические свойства ВВ
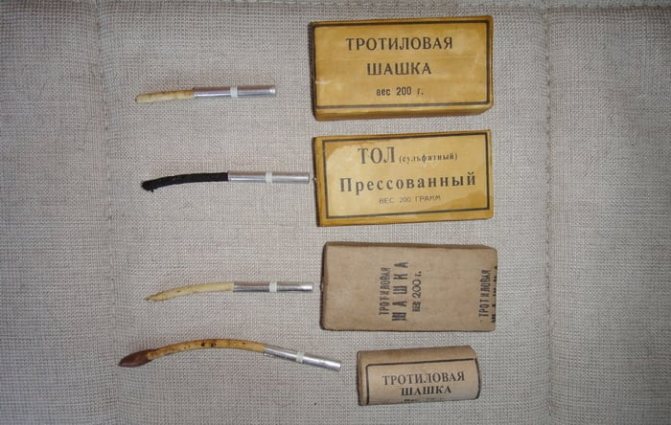
Тротил представляет собой кристаллы разных оттенков желтого или коричневого цветов, реже бесцветные. Плотность зависит от состояния, так:
- 1,663 г/см3,плотность кристаллов;
- 1,54-1,59 г/см3 плотность литого вещества.
Боевые качества тринитротолуола:
- от 4103 кДж/кг до 4605 кДж/кг теплота взрыва;
- 6950 м/с скорость детонации;
- 16 мм бризантность по методу Гесса;
- 3,9 мм бризантность методом Касса;
- 730 л/кг объем выделения газа при взрыве;
- 285 мл фугасность.
После 15 лет хранения состав становится более взрывоопасен при внешних воздействиях, о чем необходимо помнить в случае обнаружения целых боеприпасов времен Великой Отечественной войны.

ВВ не растворяется в воде, а так же не изменяет своих качеств после смачивания. Имеется активная реакция со спиртовыми и водяными щелочными растворами. На вкус горький.
Под воздействием Солнца тротил темнеет, до темно-коричневого цвета. Интересно, что в отличие от прочих взрывчаток, тол не реагирует на внешнее воздействие. Можно ударить по нему молотком, можно выстрелить в емкость с тринитротолуолом, его можно даже плавить. Последний пункт стал наиболее притягательным для военных и гражданских, связанных с взрывчаткой.
После этого масса может заполнить любую полость, буквально как пластилин. Не стоит и говорить, что ее можно резать, сверлить и делать с ней практически все что угодно.
Под воздействием огня толовая масса начинает гореть, как правило, огнем желтого цвета и выделяя черный коптящий дым. Отметим, что исключение составляет порошкообразное ВВ с некоторыми примесями, делающее взрывчатку более нестабильной.
Безопасность
Современные меры безопасности рекомендуют хранить пикриновую кислоту влажной, чтобы свести к минимуму опасность взрыва. Сухая пикриновая кислота относительно чувствительна к ударам и трению , поэтому лаборатории, которые ее используют, хранят ее в бутылках под слоем воды , что делает ее безопасной. Требуются стеклянные или пластиковые бутылки, поскольку пикриновая кислота может легко образовывать пикратные соли металлов, которые даже более чувствительны и опасны, чем сама кислота. В промышленности пикриновая кислота особенно опасна, поскольку она летучая и медленно сублимируется даже при комнатной температуре. Со временем скопление пикратов на открытых металлических поверхностях может привести к взрыву.
Марля с пикриновой кислотой, если ее найти в старинных аптечках для оказания первой помощи, представляет опасность для безопасности, поскольку пикриновая кислота этого сорта (возраст 60–90 лет) кристаллизовалась и стала нестабильной и, возможно, образовала пикраты металла в результате длительного хранения в металлических средствах оказания первой помощи. кейс.
Установки по обезвреживанию бомб часто призывают утилизировать пикриновую кислоту, если она высохла. В Соединенных Штатах в 1980-х годах предпринимались попытки удалить контейнеры с высушенной пикриновой кислотой из школьных лабораторий.
Боеприпасы, содержащие пикриновую кислоту, могут быть найдены на затонувших военных кораблях . Накопление металлических пикратов со временем делает их чувствительными к ударам и чрезвычайно опасными. Рекомендуется никоим образом не беспокоить обломки кораблей , содержащие такие боеприпасы. Опасность может исчезнуть, когда корпуса станут достаточно корродированными, чтобы впустить морскую воду, поскольку эти материалы являются водорастворимыми.
Использование в армии и мощность ВВ
На сегодняшний день тринитротолуол не используется в чистом виде как начинка боеприпасов. Его качества дополняют иные ВВ, для взаимного улучшения бризантных и других характеристик взрывчатки.
Так, гексоген и тротил увеличивают общую мощность, при этом тол повышает ее безопасность. У ВВ на основе аммиака и селитры понижается гигроскопичность, а значит они становятся более надежными, стабильными. Названия смесей ТГА (тротил, гексоген, алюминий), Октол (23% тротила и 77% оксогена), а так же айригел, алюмотол и гранатол, в которых алюминиевый порошок и тол содержатся в разных соотношениях.
Приведем небольшую сравнительную таблицу тола и других ВВ
| Плотность | Скорость взрыва | Теплота, выделяемая при взрыве | |
| Тол литой | 1,45г/см3 | 6500 м/с | 4,24МДж/кг |
| Гексоген | 1,62г/см3 | 8100 м/с | 5,54МДж/кг |
| Пикрин | 1,76 г/см³ | 7350 м/с | 7350 м/с 6,36 МДж/кг |
| Порох дымный | 1,6—1,93 г/см³ | около 3000 м/с | 2,79МДж/кг |
Ведутся поиски и новых видов ВВ, взамен устаревшего тринитротолуола. Так, армия США несколько лет использует состав IMX-101, более стабильный и безопасный.
Неожиданное применение нашли в армии для взрывчатки солдаты. Дело в том, что в небольших порциях тол прекрасно помогает от грибковых заболеваний. Самодельные мази на его основе делались ранее, и будут продолжать изготовляться, пока у солдат будут проблемы с ногами. Эту особенность использовали медики в более раннее время, но быстро выяснилось, что тол токсичен и его постоянное использование может принести больше вреда, чем пользы.
Создание тротила
В 1863 году химик Юлиус Вильбрантд, работавший в университете Гёттингена, получил интересный результат в ходе одного из экспериментов с остатками коксованного угля и нефтью. Полученный состав прекрасно горел, выделяя яркое пламя и много черного дыма. Вильбратд окрестил свой состав тринитротолуолом, однако на несколько десятков лет полученное вещество оказалось забыто.

В начале 1890-х о составе пришлось вспомнить в связи с развитием вооруженных сил. Находившиеся на тот момент на вооружении армий мира взрывчатые вещества (ВВ) обладали множеством минусов. Динамит отличается высокой чувствительностью, и снаряжать им боеприпасы опасно для самих работников фабрик, не говоря о войсках, а о транспортировке во время военных действий, вообще не приходилось и думать.
Гексоген и пикриновая кислота также крайне чувствительны, мелинит вступает в активную связь с металлом оболочки снаряда, основанные на селитре и аммиаке ВВ отличаются гигроскопичностью и быстро выходят из строя.
На фоне этих веществ тринитротолуол был едва ли не идеальной взрывчаткой, а развитие нефтяной промышленности, обеспечило его быстрое распространение.
Большую роль в этом сыграл химик Генрих Каст, по сути доведший до конца работу Вильбрантда и давший возможность производить тринитротолуол в промышленных масштабах. Кстати, название тротил было придумано для того, что бы сбить с толку русскую и иные разведки, активно искавшие, чем это занимается немецкая химическая промышленность. Происхождение слова простое, это сокращенная форма от полного названия взрывчатки.

Шило в мешке утаить невозможно, поэтому уже в 1909 году в России на Охтинском заводе стала производиться эта секретная новая взрывчатка. Первая Мировая война прошла под знаком равенства пикриновой кислоты и тола в качестве ВВ, но в послевоенный период и в эпоху Второй Мировой войны тротил стал главной взрывчаткой на планете.
Первоначально толуол, продукт, получаемый из нефти, нитровали в три стадии с последующей очисткой и кристаллизацией с помощью этилового спирта. Трудоемкий процесс, в котором было задействовано ценное, «дефицитное» сырье, изменили в 1932-1933 годах.
Модернизация позволила пустить спирт на более важные нужды, его заменили кислотой. Сильно мешал факт прерывающегося производства взрывчатки. В 1936 году был опробована и принята технология производства тринитротолуола непрерывного типа в четыре фазы. В послевоенное время создавались новые способы непрерывного производства тротила для армии и промышленности.
Особенностью их было использование концентрированных кислот. В этом отечественная промышленность серьезно обгоняла западных конкурентов, так как и в Германии, и в Англии, и в США производство ВВ было не так дешево и эффективно как в СССР, и, как правило, было прерывающегося типа.
Хлорпикрин как боевое отравляющее вещество (ОВ)[ | код]
Пары хлорпикрина обладают сильным слезоточивым, а в высоких концентрациях — удушающим и общеядовитым действием. В связи с этим хлорпикрин ограниченно применялся в Первой мировой войне как боевое отравляющее вещество (например, против русской армии летом 1915 года), а также в качестве растворителя для боевого применения других БОВ (впервые — в середине 1916 года немецкой армией в смеси с дифосгеном).
Во время подавления антибольшевистского восстания в Тамбовской губернии зафиксировано три случая применения снарядов типа АЖО с хлорпикрином для выкуривания повстанцев из леса, не приведшие к заметным результатам.
Из-за невысокой для современных ОВ токсичности и сильного раздражающего действия хлорпикрин не рассматривается как боевое ОВ. С другими ОВ хлорпикрин также в настоящее время не используется, поскольку его раздражающее действие практически сразу дало бы возможность обнаружить применение ОВ.
Благодаря раздражающему действию и простоте обращения хлорпикрин с 1920-х гг. использовался в качестве учебного (имитация газовой атаки) и проверочного (тестирование средств химзащиты) ОВ. Для этого в армейской палатке умеренное количество хлорпикрина, порядка 50 мл, подогревалось на водяной бане
Однако из-за того, что при нагревании хлорпикрин разлагается с образованием фосгена, применение его в качестве учебного ОВ требовало соблюдения мер предосторожности, и вопрос о его замене в РККА ставился по крайней мере с 1937 года. Во время холодной войны подогрев хлорпикрина заменили на учебные рецептуры ИВ-Б и ИВ-2 для имитационных гранат и фугасов (ИГС, ИФ), но проблема токсичности осталась.
Конвенция ОЗХО запретила военное применение хлорпикрина, приравняв его к фосгену, хлорциану и синильной кислоте, поэтому его запасы уничтожены, а как учебное ОВ он заменён другими ОВ раздражающего действия (в ВС РФ используются, например, рецептуры УБСОВ-2 и УБСОВ-Б с хлорацетофеноном).
Использует
Безусловно, наибольшее распространение получили боеприпасы и взрывчатые вещества. Взрывчатое вещество D , также известное как дуннит, представляет собой аммонийную соль пикриновой кислоты. Даннит более мощный, но менее стабильный, чем более распространенное взрывчатое вещество TNT (которое производится аналогично пикриновой кислоте, но с толуолом в качестве сырья). Пикрамид, образованный аминированием пикриновой кислоты (обычно начинающейся с дуннита), может быть дополнительно аминирован для получения очень стабильного взрывчатого вещества ТАТБ .
Он нашел некоторое применение в органической химии для получения кристаллических солей органических оснований (пикратов) с целью идентификации и характеристики.
В металлургии 4% пикриновая кислота в этаноле, называемая «пикраль», обычно используется в оптической металлографии для выявления предшествующих границ зерен аустенита в ферритных сталях. Опасности, связанные с пикриновой кислотой, привели к тому, что ее в значительной степени заменили другими химическими травителями. Однако он все еще используется для травления магниевых сплавов, таких как AZ31.
Раствор буина — это обычный фиксирующий раствор, содержащий пикриновую кислоту, используемый для гистологических образцов. Он улучшает окрашивание кислотных красителей, но также может приводить к гидролизу любой ДНК в образце.
В лабораторных исследованиях клинической химии используется пикриновая кислота для реакции Яффе на креатинин . Он образует окрашенный комплекс, который можно измерить с помощью спектроскопии.
Пикриновая кислота образует красный изопурпурат с цианистым водородом (HCN). Пикриновая кислота может быть использована для количественного определения цианистого водорода путем фотометрического измерения полученного красителя.
В начале 20 века пикриновая кислота использовалась для измерения уровня глюкозы в крови. Когда глюкоза, пикриновая кислота и карбонат натрия смешиваются и нагреваются, образуется характерный красный цвет. При калибровке раствора глюкозы красный цвет можно использовать для измерения добавленного уровня глюкозы. Это известно как метод измерения глюкозы по методу Льюиса и Бенедикта.
Гораздо реже влажная пикриновая кислота использовалась в качестве краски для кожи или временного брендового агента. Он вступает в реакцию с белками кожи и дает темно-коричневый цвет, который может сохраняться до месяца.
В начале 20-го века пикриновая кислота продавалась в аптеках как антисептик и как средство от ожогов , малярии , герпеса и оспы . В то время марля, пропитанная пикриновой кислотой, также обычно использовалась в аптечках для лечения ожогов. В частности, он использовался для лечения ожогов, полученных жертвами катастрофы в Гинденбурге в 1937 году. Пикриновая кислота также использовалась для лечения траншейной стопы солдат, дислоцированных на Западном фронте во время Первой мировой войны .
Пикриновая кислота в течение многих лет использовалась тайерами для окрашивания шкур и перьев кротов в темно-оливково-зеленый цвет для использования в качестве приманок. Его популярность сдерживалась его токсичной природой.
ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
1.1a. Хлорпикрин должен изготовляться в соответствии с требованиями настоящего стандарта по технологическому регламенту, утвержденному в установленном порядке.(Введен дополнительно, Изм. N 2).
1.1. По физико-химическим показателям хлорпикрин должен соответствовать требованиям и нормам, указанным в табл.1.
Таблица 1
|
Наименование показателя |
Норма |
|
1. Внешний вид |
Маслянистая жидкость бесцветная или слабоокрашенная в желто-зеленый цвет |
|
2. Плотность , г/см |
1,659-1,663 |
|
3. Массовая доля хлорпикрина, %, не менее |
99 |
|
4. Массовая доля свободных кислот в пересчете на НNО, %, не более |
0,005 |
|
5. (Исключен, Изм. N 1). |
|
|
6. Содержание воды, отстоя и взвешенных механических примесей |
Не допускается |
Общие «взрывные» качества
Подрыв шашки тринитротолуола может быть гарантированно произведен с помощью детонатора или запала. Как было отмечено, обладающее большим запасом стабильности вещество непросто подорвать «как в кино», выстрелом или даже поджогом.

Что же произойдёт, если подорвать, к примеру, 1 килограмм тротила. Взрыв, то есть мгновенная химико-физическая реакция, протечет за одну стотысячную долю секунды. Газ, образование и расширение которого и дает основную фугасную составляющую взрыва и взрывной волны, увеличиться до объема в 700 литров. Основным поражающим фактором будет взрывная волна и соответствующее изменение давления.
Токсические свойства
Хлорпикрин раздражает кожу и слизистые оболочки. Он вызывает слезотечение, смыкание век, бронхит и отёк лёгких. У поражённого начинаются сильнейшие неконтролируемые конвульсии мышц диафрагмы. Жидкий хлорпикрин вызывает тяжёлые поражения кожи.
У большинства людей концентрация 0,002 мг/л за 3—30 с вызывает слезотечение и смыкание век, концентрация 0,05 мг/л — непереносима. Более высокие концентрации ведут к болям в области желудка, рвоте и потере сознания. Концентрация около 0,2 мг/л за несколько секунд или минут приводит к полной утрате боеспособности. Опасность хлорпикрина проявляется в том, что до некоторого предела концентрации он воспринимается на запах просто как умеренно пахнущее горчицей вещество, описанные выше симптомы поражения возникают внезапно.
Поражение органов дыхания появляется при концентрации выше 0,1 мг/л. В качестве смертельной концентрации указывают 2 мг/л при экспозиции 10 мин. При такой концентрации смерть наступает в течение нескольких минут.
Общая характеристика
Вскрытие входной двери с помощью компактного подрывного заряда (2008 год) Любое взрывчатое вещество обладает следующими характеристиками:
- способность к экзотермическим химическим превращениям
- способность к самораспространяющемуся химическому превращению
Важнейшими характеристиками взрывчатых веществ являются:
- скорость взрывчатого превращения (скорость детонации или скорость горения),
- давление детонации,
- теплота (удельная теплота) взрыва,
- состав и объём газовых продуктов взрывчатого превращения,
- максимальная температура продуктов взрыва (температура взрыва),
- чувствительность к внешним воздействиям,
- критический диаметр детонации,
- критическая плотность детонации.
При детонации разложение взрывчатых веществ происходит настолько быстро (за время от 10−6 до 10−2сек), что газообразные продукты разложения с температурой в несколько тысяч градусов оказываются сжатыми в объёме, близком к начальному объёму заряда. Резко расширяясь, они являются основным первичным фактором разрушительного действия взрыва.
Различают два основных вида действия взрывчатых веществ: бризантное (местного действия) и фугасное (общего действия).
Существенное значение при хранении взрывчатых веществ и обращении с ними имеет их стабильность.
В прикладных сферах широко используется не более двух-трёх десятков взрывчатых веществ и их смесей. Основные характеристики наиболее распространённых из них сведены в следующую таблицу (данные приведены при плотности заряда 1600 кг/м3):
| Взрывчатое вещество | Кислородный баланс, % | Теплота взрыва, МДж/кг | Объём продуктов взрыва, м3/кг | Скорость детонации, км/с |
| Тротил | -74,0 | 4,2 | 0,75 | 7,0 |
| Тетрил | -47,4 | 4,6 | 0,74 | 7,6 |
| Гексоген | -21,6 | 5,4 | 0,89 | 8,1 |
| Тэн | -10,1 | 5,9 | 0,79 | 7,8 |
| Нитроглицерин | +3,5 | 6,3 | 0,69 | 7,7 |
| Аммонит № 6 | 4,2 | 0,89 | 5,0 | |
| Нитрат аммония | +20,0 | 1,6 | 0,98 | ≈1,5 |
| Азид свинца | неприменимо | 1,7 | 0,23 | 5,3 |
| Баллиститный порох | -45 | 3,56 | 0,97 | 7,0 |
Методы синтеза
Хлорпикрин впервые получил шотландский химик Джон Стенхауз ещё в 1848 году при взаимодействии 2,4,6-тринитрофенола (пикриновой кислоты) с хлорной известью. Позднее этот старинный процесс был использован в промышленных процессах, при помощи которых в первую мировую войну хлорпикрин получали для военных целей. Действие гипохлоритов кальция (то есть дешёвой хлорной извести) приводит к расщеплению цикла 2,4,6- тринитрофенола и одновременно к хлорированию продуктов расщепления.
Вместо трудно растворимой пикриновой кислоты применяли легкорастворимый пикрат кальция, который получали смешением пикриновой кислоты с окисью кальция, и к смеси добавляли кашицу хлорной извести. Теплоты этой реакции достаточно для испарения образующегося хлорпикрина, пары которого затем конденсируют. Затем хлорпикрин легко перегоняется с водяным паром для очистки.
В реакции можно использовать не только хлорную известь, но другие гипохлориты — в том числе и образующиеся in situ при пропускании хлора в щелочной раствор пикриновой кислоты, либо других нитрофенолов.
В настоящее время основным промышленным способом синтеза хлорпикрина является хлорирование нитрометана в щелочной среде:
-
- CH3NO2+3NaOCl→Cl3CNO2+3NaOH{\displaystyle {\mathsf {CH_{3}NO_{2}+3NaOCl\rightarrow Cl_{3}CNO_{2}+3NaOH}}}
Хлорпикрин может также быть синтезирован нитрованием хлороформа ацетилнитратом:
-
- CHCl3+CH3COONO2→Cl3CNO2+CH3COOH{\displaystyle {\mathsf {CHCl_{3}+CH_{3}COONO_{2}\rightarrow Cl_{3}CNO_{2}+CH_{3}COOH}}}
Аварийная карточка (АХОВ)
В случае возгорания в окрестностях: разрешены все средства пожаротушения. Провести эвакуацию из опасной зоны!
Проконсультироваться со специалистом! Как можно скорее собрать подтекающую и пролитую жидкость в герметичные контейнеры. Засыпать оставшуюся жидкость песком или инертным абсорбентом, собрать и удалить его в безопасное место.
При ликвидации аварий, связанных с разливом хлорпикрина изолировать опасную зону, удалить из нее людей, держаться с наветренной стороны, избегать низких мест, в зону аварии входить только в полной защитной одежде. Непосредственно на месте аварии и вблизи источника заражения работы проводят в изолирующих костюмах, комбинезонах (Л-1, КИХ-4, КИХ-5 и др.), изолирующих противогазах и дыхательных аппаратах (ИП-4м, АИР-98МИ, ИВА-24М, КИП-8). Для выхода из зоны заражения и при работах по ликвидации аварии на удалении 300-500 м от источника заражения используют фильтрующие промышленные, гражданские и детские противогазы с коробками марки А, В, БКФ.
Нейтрализуют хлорпикрин 5%-ным раствором сульфида натрия (например, 50 кг сульфида натрия и 950 литров воды). Для нейтрализации 1 тонны хлорпикрина используется 14 тонн раствора сернистого натрия.Для рассеивания паров используют распыленную воду. Для распыления воды применяют авторазливочные станции (АРС-14, АРС-15), мотопомпы (МП-800), а также имеющиеся на химически опасных объектах гидранты и спецсистемы.
Место разлива обваловывают и не допускают попадания вещества в поверхностные воды, промывают большим количеством воды, покрывают воздушно-механической пеной. Для утилизации загрязненного грунта на месте разлива при нейтрализации хлорпикрина срезают поверхностный слой грунта на глубину загрязнения, собирают и вывозят на утилизацию с помощью землеройно-транспортных машин (бульдозеров, скреперов, автогрейдеров, самосвалов). Места срезов засыпают свежим слоем грунта, промывают водой в контрольных целях
ПЕРВАЯ ПОМОЩЬ
В зараженной зоне: надевание противогаза на пострадавшего, срочный вывод (вывоз) из зоны заражения.
После эвакуации из зараженной зоны: тепло, покой, кислородные ингаляции, при раздражении глаз обильное промывание 2% раствором питьевой соды или водой, закапывание в глаза 1-2 капель 1%-ного раствора дикаина, для профилактики отека легких – внутримышечно 2 мл 4% раствора метилпреднизолона. Полусидячее положение. Удалить загрязненную одежду. Прополоскать рот. Дать выпить большое количество воды.
ВАЖНЫЕ ДАННЫЕ
ФИЗИЧЕСКОЕ СОСТОЯНИЕ, ВНЕШНИЙ ВИД:
СЛЕГКА МАСЛЯНИСТАЯ, БЕСЦВЕТНАЯ ЖИДКОСТЬ С РЕЗКИМ ЗАПАХОМ
Пар тяжелее воздуха.
Может взрываться при нагревании и при сотрясении. Вещество разлагается при разогреве и под влиянием света с образованием токсичных паров, в том числе хлористого водорода и оксидов азота. Реагирует бурно со спиртовым раствором гидроксида натрия, метоксидом натрия, пропаргил бромидом, анилином при нагревании.
ПУТИ ПОСТУПЛЕНИЯ:
Вещество может всасываться в организм при вдыхании паров и через рот.
РИСК ПРИ ВДЫХАНИИ:
Опасное загрязнение воздуха будет достигаться очень быстро при испарении этого вещества при 20°C.
ВЛИЯНИЕ КРАТКОВРЕМЕННОГО ВОЗДЕЙСТВИЯ:
Слезоточивое действие. Вещество раздражает (сильно) глаза, кожу и дыхательные пути. Вдыхание пара может вызвать отек легких (см. Примечания). Воздействие на уровне, превышающем OEL может вызвать смерть. Эффекты могут быть отсроченными. Показано медицинское наблюдение.
НАЛИЧИЕ ХЛОРПИКРИНА ОПРЕДЕЛЯЮТ:
ФИЗИЧЕСКИЕ СВОЙСТВА ПРЕДЕЛЬНО ДОПУСТИМАЯ КОНЦЕНТРАЦИЯ (ПДК)
Первая врачебная помощь
Полная санитарная обработка (в положении лежа), не допускать переохлаждения. Ингаляция увлажненным кислородом через пеногаситель . При брадикардии подкожно вводят 1 мл 0,1% раствора атропина. При раздражении дыхательных путей — ингаляция спрея лидокаина 4% (с помощью комплекта «Алмаз»). При поражении глаз — промывание глаз 2% раствором натрия гидрокарбоната, глазная мазь с антибиотиками (5% левомицетиновая глазная мазь), при болевом синдроме — 0,1–0,2% раствор тетракаина (Дикаина).
Для профилактики развития отека легких: ГК (в пересчете на преднизолон от 150 мг), антигистаминные препараты в максимальной суточной дозировке. Купирование бронхоспазма ингаляционным использованием адреномиметиков. Ограничить количество вводимой жидкости! Экстренная эвакуация в положении лежа на носилках, в сопровождении врача. В пути продолжать терапию, ингаляцию кислорода.
При наступлении альвеолярного отека больному придают функционально удобное положение (с приподнятой верхней половиной туловища), проводят оксигенотерапию с ингаляцией противовспенивающих средств (, ингаляции бронхолитиков (сальбутамол), назначают антибиотики. При выраженных нарушениях дыхания проводятся интубация и ИВЛ с созданием положительного давления в конце выдоха (positive end-expiratory pressure — PEEP).
структура

На верхнем изображении все связи и сама структура молекулы пикриновой кислоты показаны более подробно. Состоит из фенола с тремя нитрозаместителями.
Видно, что в NO группах2 атом азота имеет положительный частичный заряд, и поэтому требуется электронная плотность его окружения. Но, ароматическое кольцо также притягивает электроны к себе, и до трех NO2 в конечном итоге он отказывается от части своей электронной плотности.
Как следствие этого, кислород группы ОН имеет тенденцию в большей степени разделять одну из своих свободных электронных пар, чтобы обеспечить дефицит электроники, испытываемый кольцом; и при этом формируется ссылка C = O+-H. Эта частичная частичная нагрузка на кислород ослабляет связь O-H и повышает кислотность; то есть он будет выделяться в виде иона водорода, H+.
Кислотный фенол
Именно по этой причине это соединение является исключительно сильной (и реакционноспособной) кислотой, даже больше, чем сама уксусная кислота. Однако соединение действительно представляет собой фенол, кислотность которого превосходит кислотность других фенолов; благодаря, как только что упомянуто, заместителям NO2.
Следовательно, поскольку это фенол, группа ОН имеет приоритет и управляет подсчетом в структуре. Три НЕТ2 они расположены в атомах углерода 2, 4 и 6 ароматического кольца относительно ОН. Отсюда номенклатура IUPAC для этого соединения: 2,4,6-тринитрофенол (TNP, для его сокращения на английском языке).
Если бы группы не были2, или если бы их было меньше в кольце, связь О-Н ослабла бы меньше, и, следовательно, соединение имело бы более низкую кислотность.
Кристаллическая структура
Молекулы пикриновой кислоты расположены таким образом, чтобы способствовать их межмолекулярным взаимодействиям; либо для образования водородных мостиков между группами ОН и NO2, диполь-дипольные силы или электростатические отталкивания между дефектными областями электронов.
Можно ожидать, что группы НЕ2 они отталкиваются друг от друга и будут ориентированы на соседние ароматические кольца. Кроме того, кольца не могли быть совмещены друг с другом из-за увеличения электростатических отталкиваний.
Продукт всех этих взаимодействий — пикриновая кислота — образует трехмерную сеть, которая определяет кристалл; элементарная ячейка которой соответствует кристаллической системе орторомбического типа.
ссылки
- Грэм Соломонс Т.В., Крейг Б. Фрайл. (2011). Органическая химия. Амины. (10го издание.). Wiley Plus.
- Кэри Ф. (2008). Органическая химия (Шестое издание). Mc Graw Hill.
- Wikipedia. (2018). Пикриновая кислота Получено с: en.wikipedia.org
- Университет Пердью. (2004). Взрыв пикриновой кислоты. Получено от: chemed.chem.purdue.edu
- Кристаллография 365 проект. (10 февраля 2014 г.) Меньше нежно-желтого — структура пикриновой кислоты. Получено из: crystallography365.wordpress.com
- PubChem. (2019). Пикриновая кислота Получено из: pubchem.ncbi.nlm.nih.gov
- Бейкер Дж. Р. (1958). Пикриновая кислота Метуэн, Лондон, Великобритания.