Лекарственные средства на основе бензола
Содержание:
Химическая промышленность
Если перечислять области применение бензола, то их очень много. Однако в некоторых он играет одну из ключевых ролей, например в химической промышленности. Здесь этот компонент является одним из наиболее востребованных, так как он является исходным элементом для производства множества других, а также является растворителем во многих операциях. Стоит отметить, что бензол способен растворить практически любые органические соединения. Если в первой половине 20-го века применение бензола приходилось в основном на создание таких составов, как нитро- и динитросоединения, то на сегодняшний день самыми распространенными веществами стали этилбензол, кумол и циклогексан. 60 % всего бензола приходится именно на создание первых двух элементов.

Безопасность
Работа с применением бензола сопряжена с риском отравления и серьёзного ухудшения здоровья. Бензол — легколетучая жидкость (летучесть 320 мг/л при 20 °С) с высокой степенью воспламенения, поэтому при работе с ним необходимо соблюдать технику безопасности работ с легковоспламеняющимися жидкостями. Большую опасность представляют пары бензола, так как они могут образовывать взрывоопасные смеси с воздухом. В настоящее время применение бензола в качестве органического растворителя сильно ограничено, ввиду токсичности и канцерогенного воздействия его паров и негативном воздействии на кожу. Работа с бензолом в лабораториях также предусматривает его ограничение (строго регламентирована). Бензол рекомендуется использовать в экспериментах лишь в небольших объёмах (не более 50 мл), работа должна проводиться исключительно в перчатках из фторкаучука (латекс растворяется и набухает при воздействии на него бензолом).
Категорически запрещается:
- хранить вблизи источников тепла, открытого огня, сильных окислителей, пищевых продуктов, и так далее,
- оставлять в открытом виде тару, содержащую бензол, курить,
- использовать тару из-под бензола для пищевого применения, мытья рук, посуды,
- производить работу в закрытом, плохо вентилируемом помещении с температурой воздуха больше 30°С,
- использовать большой объём вещества в качестве растворителя,
- работать без средств защиты кожи рук, глаз и органов дыхания.
ПДК в воздухе составляет 5 мг/м3 (среднесменная за 8 часов).
Охрана труда
В России ПДК бензола в воздухе рабочей зоны установлена равной 5 мг/м3 (среднесменная за 8 часов) и 15 мг/м3 (максимально-разовая). Однако по данным ряда исследований, порог восприятия запаха этого вещества может быть гораздо выше ПДКрз. Например, среднее значение порога в исследовании было в ~ 100 раз выше среднесменной ПДКрз, и в ~ 30 раз выше максимально-разовой ПДКрз. А у части людей порог был значительно выше среднего значения. Поэтому можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками СИЗОД) приведёт к чрезмерному воздействию паров бензола на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от бензола следует использовать значительно более эффективные изменение технологии и средства коллективной защиты.
Химия10 класс
§ 7. Арены. Бензол
Бензол С6Н6 является первым представителем аренов. Его можно получить тримеризацией ацетилена:
В больших количествах бензол получают переработкой каменного угля.
Ф. Кекуле предложил следующую структурную формулу бензола:
Несмотря на высокую степень непредельности молекулы бензола (по составу), он не дает характерных для алкенов и алкинов качественных реакций: не обесцвечивает бромную воду и раствор перманганата калия. Это связано с особым строением молекулы бензола, которое в настоящее время показывают следующей структурной формулой:
и подробно изучают в курсе органической химии для школ и классов естественнонаучного профиля. Для вас достаточно иметь общее представление о строении молекулы бензола, которое представлено на рисунке 25.
Рис 25. Масштабная модель молекулы бензола
Бензол — это бесцветная жидкость с резким характерным запахом, легче воды и нерастворима в ней. Бензол токсичен, поэтому работа с ним в условиях школы недопустима.
Рассмотрим химические свойства бензола.
Как и все углеводороды, бензол горит:

Пламя бензола коптящее из-за высокого содержания углерода в молекуле.
Бензол используют как добавку к моторному топливу, так как он повышает качество бензина. Однако количество добавляемого бензола строго регламентировано из-за его токсичности.
В силу особенностей строения молекулы бензол занимает как бы промежуточное положение между предельными углеводородами (алканами) и непредельными (алкенами), т. е. может вступать как в реакции замещения, так и в реакции присоединения. Однако, в отличие от алканов, реакции замещения с бензолом протекают легче, а реакции присоединения — труднее, чем у алкенов. Последние мы рассматривать не будем, остановимся лишь на реакциях замещения, так как в результате этих реакций образуются вещества, которые используют для производства практически важных продуктов.
Реакция хлорирования бензола протекает в присутствии катализатора:
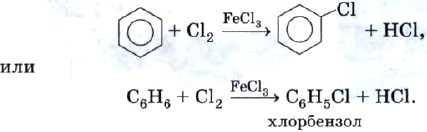
Полученный продукт называют также фенилхлоридом, так как одновалентный радикал С6Н5 — называют фенилом.
Реакция нитрования — это взаимодействие бензола с азотной кислотой HNO3. Эта реакция протекает в присутствии концентрированной серной кислоты в качестве катализатора:
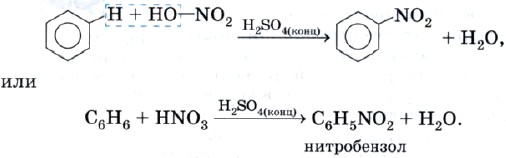
Полученный продукт называют нитробензолом. Почему нитробензолом? Потому что группу атомов — NO2 называют нитрогруппой.
Нитробензол — исходное вещество для получения анилина, который будет рассмотрен в § 16.
Области применения бензола показаны на рисунке 26.
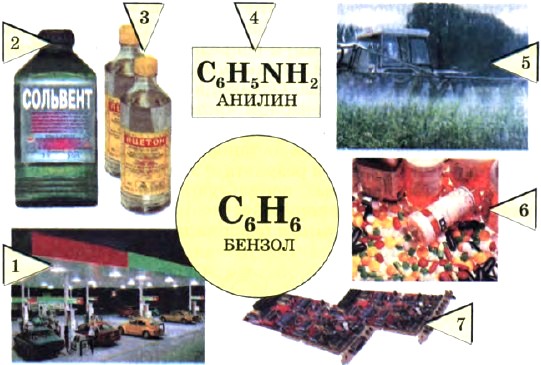
Рис. 26. Применение бензола: 1 — добавка к бензину; 2 — производство растворителей; 3—7 — производство органических соединений {ацетона 3, анилина 4, пестицидов 5, лекарственных средств 6, фенолоформальдегидных пластмасс 7)
Новые слова и понятия
- Бензол.
- Получение бензола.
- Химические свойства бензола: горение, реакции замещения с хлором и азотной кислотой.
- Применение бензола.
Вопросы и задания
- Как вы думаете, при горении какого углеводорода — бензола или ацетилена — пламя будет более коптящим? Почему? Ответ подтвердите расчетами.
- Перечислите области применения бензола.
- Рассчитайте количество вещества ацетилена, который потребуется доя получения 400 мл бензола (плотность 0,8 г/мл).
-
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) метан→ацетилен→бензол→хлорбензол;
б) карбонат кальция→оксид кальция→карбид кальция→ацетилен→бензол→нитробензол.
- Бензол является прекрасным растворителем органических веществ и входит в состав многих бытовых препаратов-растворителей, например в состав «Сольвента», где его содержание составляет 25%. Рассчитайте массу бензола, которая необходима для изготовления 300 г «Сольвента».
Химические свойства
Вследствие значительной устойчивости π-облака для бензола, в отличие от неароматических непредельных углеводородов, характерные реакции замещения, а не присоединения, поскольку они должны приводить к потере ароматичности, однако реакции присоединения также могут происходить за достаточно жестких условий. Замещение происходит электрофильным механизмом. Также бензол вступает в реакции окисления.
Реакции электрофильного замещения
Бензол вступает в реакции электрофильного замещения, происходящих по такому механизму: на первой стадии происходит образование π-комплекса между электрофилом (в форме катиона или сильно поляризованной молекулы E σ +-Nu σ-) и молекулой бензола, в результате перекрывания НСМО Электрофиль с ВЗМО ( π-облаком) бензола. После этого пара p-электронов выходит из сопряженного бензольного кольца и участвует в образовании σ-связи с электрофилом, таким образом π-комплекс превращается в σ-комплекс или интермедиат Уэлланда. Эта промежуточное соединение имеет положительный заряд и лишена ароматического характера, из-за чего менее устойчивой по сравнению с ароматическим кольцом, в которое обычно быстро превращается в результате отщепления протона (этот этап происходит через еще один промежуточный π-комплекс).
Алкилирование и ацилирование по Фриделем-Крафтса
Алкилирование бензола осуществляется алкилгалогенидами, алкенами и спиртами, ацилирование — карбоновыми кислотами, галогенангидриды и ангидридами, оба типа реакций катализируемых кислотами Льюиса. Эти реакции назван в честь их первооткрывателей Шарля Фриделя и Джеймса Крафтса.
Роль катализатора в этом типе реакций заключается в том, что он взаимодействует с алкилирующие или ацилюючим реагентом и обеспечивает образование карбкатион или поляризованного комплекса. Например, при взаимодействии Хлорметан и алюминий хлорида образуется комплекс с усиленной електрофильнистю атома углерода:
Примером реакции алкилирование может быть этилирования бензола хлорэтан.
Однако в промышленности етилбензен чаще получают реакцией с этиленом, которая также проходит в присутствии оксида алюминия, фосфорной или серной кислоты:
Продуктами реакций ацилирования бензола являются ароматические кетоны. Примером может быть реакция с ацетилхлоридом, продуктом которой является метиларилкетон:
Галогенирования
В отличие от ненасыщенных углеводородов бензол НЕ обесцвечивает бромную воду. Но для него характерны реакции галогенирования, происходящих по механизму электрофильного замещения, в присутствии кислот Льюиса. Например, при взаимодействии с бромом образуется бромбензол:
Нитрования
Характерной для бензола реакция нитрования использующая нитрующей смесь, которая состоит из концентрированной азотной кислоты и концентрированной серной кислоты как водоотнимающих средства. В этой реакции образуется нитробензен, что является предшественником в синтезе анилина
Сульфирование
При воздействии на бензол концентрированной серной кислоты происходит его сульфирования с образованием бензосульфоновои кислоты, может быть предшественником в синтезе фенола:
Реакции присоединения
Бензол вступает и в реакции присоединения, но значительно труднее, чем в реакции замещения. При этом он проявляет свойства непредельных углеводородов. Так, в присутствии никелевого катализатора и при нагревании происходит реакция гидрирования бензола с образованием циклогексана:
При этом атомы водорода присоединяются молекулой бензола за счет разрыва двойных связей. Бензол вступает также в реакцию присоединения одной, двух или трех молекул хлора. Эта реакция происходит свободнорадикальным механизмом для образования радикалов хлора необходимо ультрафиолетовый свет (достигается облучением ртутно-кварцевой лампой). Продуктом полного присоединения является гексахлорциклогексан:
Реакции окисления
На воздухе бензол горит сильно копоти пламенем, поскольку содержание углерода в нем значений. Смесь пары бензола с воздухом взрывная. Благодаря ароматическом характера бензол устойчив к воздействию окислителей: не окисляется раствором перманганата калия и азотной кислотой. В присутствии катализатора ванадий (V) оксида реагирует с молекулярным кислородом, в результате чего образуется малеиновый ангидрид:
Также бензол окисляется озоном, эта реакция исторически использовалась для установления его строения.
Функции парааминобензойной кислоты.
Биологическое действие витамина В10: участие в синтезе фолиевой кислоты, нормализация обмена веществ в соединительной ткани, обмена меланина и др. Действие витамина В10 на организм человека взаимосвязано с гормонами, которые вырабатываются щитовидной железой, яичниками и надпочечниками. ПАБК повышает устойчивость организма к действию ультрафиолетовых лучей, ядов, к возбудителям инфекций и кислородному голоданию.
Биологическая роль парааминобензойной кислоты изучена до сих пор в недостаточной мере. Известно, что она участвует в синтезе фолиевой кислоты и присутствует в качестве компонента в молекулах фолиевой и фолиновой кислот, участвует в образовании эритроцитов, предупреждая развитие анемии. ПАБК помогает усвоению жиров и белка, имеет лактогонные свойства — помогает выработке молока у кормящих мам.
Парааминобензойная кислота повышает тонус кожи, предупреждает преждевременное ее увядание. Это соединение используют практически во всех солнцезащитных лосьонах и кремах. Под воздействием ультрафиолетовых лучей кислота подвергается превращениям, которые помогают синтезировать вещества, стимулирующих выработку меланина — пигмента, обеспечивающего появление загара. Витамин В10 поддерживает естественную окраску волос и обеспечивает их рост.
Парааминобензойная кислота назначается при таких заболеваниях, как задержка развития, повышенная физическая и умственная утомляемость; анемия фолиеводефицитная; болезнь Пейрони, артрит, посттравматическая контрактура и контрактура Дюпьютрена; светочувствительность кожи, витилиго, склеродерма, ожоги ультрафиолетовыми лучами, алопеция, раннее появление седины и др.
Применение
Перевозка бензола железнодорожным транспортом осуществляется в специализированных вагонах-цистернах
Значительную часть получаемого бензола используют для синтеза других продуктов:
- около 50 % бензола превращают в этилбензол (алкилирование бензола этиленом);
- около 25 % бензола превращают в кумол (алкилирование бензола пропиленом);
- приблизительно 10—15 % бензола гидрируют в циклогексан;
- около 10 % бензола расходуют на производство нитробензола;
- 2—3 % бензола превращают в линейные алкилбензолы;
- приблизительно 1 % бензола используется для синтеза хлорбензола.
В существенно меньших количествах бензол используют для синтеза некоторых других соединений. Изредка и в крайних случаях, ввиду высокой токсичности, бензол используют в качестве растворителя.
Кроме того, бензол входит в состав бензина. В 1920-х — 1930-х годах, бензол добавлялиrude в прямогонный бензин для повышения его октанового числа, но к 1940-м годам такие смеси не выдержали конкуренции с высокооктановыми бензинами. Ввиду высокой токсичности содержание бензола в топливе ограничено современными стандартами введением до 1 %.
Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
|
Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду.
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2+: |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Профилактика
Класс опасности бензола — II по Стандарту ГОСТ 12.1.005–88 «Классификация вредных веществ и общие требования безопасности». Токсический эффект бывает как при кратковременном воздействии большого количества вещества, так и при длительном, хроническом влиянии в небольших дозах.
В связи с тем, что работа с бензолом опасна возможностью отравления, она строго регламентирована. Инструкция по технике безопасности содержит описание того, как хранить бензол, перечень правил работы с ним, указание предельно допустимой концентрации вещества. Содержать его необходимо в закрытой, маркированной таре на территории отапливаемых складских помещений.
 Предельная допустимая концентрация (ПДК) бензола в воздухе рабочей зоны должна находиться в пределах 5–15 мг/м3. При её превышении, в случае явной или предполагаемой утечки, аварийные работы проводят с использованием специальных средств защиты. К ним относятся — фильтрующий противогаз, фартук или защитный костюм из прорезиненной ткани, резиновые перчатки и сапоги, специальные кремы и пасты.
Предельная допустимая концентрация (ПДК) бензола в воздухе рабочей зоны должна находиться в пределах 5–15 мг/м3. При её превышении, в случае явной или предполагаемой утечки, аварийные работы проводят с использованием специальных средств защиты. К ним относятся — фильтрующий противогаз, фартук или защитный костюм из прорезиненной ткани, резиновые перчатки и сапоги, специальные кремы и пасты.
Таким образом, для предупреждения острых и хронических интоксикаций требуется выполнение следующих мер:
- соблюдение отраслевых стандартов оборудования рабочих помещений — герметизация аппаратуры, наличие вытяжных вентиляций, автоматизация процессов, связанных с опасным производством;
- контроль содержания бензола в воздухе рабочей зоны с помощью специальных датчиков;
- использование при работе с бензолом индивидуальных средств защиты — органов дыхания, кожи рук, глаз;
- применение эффективных средств очистки кожи;
- соблюдение техники безопасности;
- проведение медицинских осмотров для установления профессиональной пригодности;
- предоставление льгот, положенных при взаимодействии с вредными веществами — перерывы в работе, усиленное питание, льготный трудовой стаж, дополнительный отпуск;
- проведение ежегодных медицинских осмотров.
Подведём итоги. Бензол — это природное органическое соединение, которое является токсичным веществом. Вдыхание его паров, случайный приём внутрь или попадание на открытые участки кожи ведёт к отравлению. Обычно это случается при аварийных ситуациях на предприятиях или несчастных случаях в быту. При остром отравлении бензол оказывает нейротоксическое действие. При хронической интоксикации проявляется его гемотоксический эффект. Первоочерёдные меры при отравлениях направлены на исключение дальнейшего действия яда на организм. Лечение проводится в специализированных отделениях, которое заключается в нейтрализации и удалении яда, а также восстановление жизненно важных функций организма. Соблюдение мер профилактики помогает свести к минимуму количество несчастных случаев в быту и на производстве. Достоверная информация о токсичных свойствах бензола позволяет безопасно использовать это необходимое людям вещество.
Отравление бензолом
Строение бензола
Современная теория строения молекулы бензола базируется на представлении о гибридизации орбиталей атома углерода.
Учебный фильм «Строение молекулы бензола»
Согласно этой теории, атомы углерода в бензоле находятся в состоянии sp2-гибридизации.
Каждый атом углерода образует три σ-связи (две с атомами углерода и одну – с атомом водорода). Валентные углы между каждой парой σ-связей равны 120°. Таким образом, все шесть атомов углерода и все σ-связи С-С и С-лежат в одной плоскости, образуя правильный шестиугольник (σ-скелет молекулы бензола).
Каждый атом углерода имеет одну негибридную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскому σ-скелету и параллельно друг другу. Все шесть р-электронов взаимодействуют между собой, образуя π-связи, не локализованные в пары, как при образовании обычных двойных связей, а образующие единое π-электронное облако и единую химическую связь для всех атомов углерода.
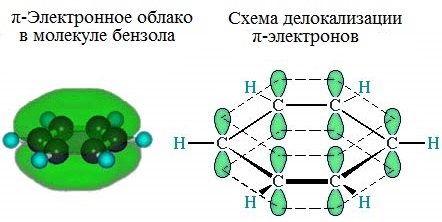
Таким образом, в молекуле бензола осуществляется круговое сопряжение, образуется единая сопряженная π-система. Наибольшая π-электронная плотность в этой сопряженной системе располагается над и под плоскостью σ-скелета.
Сочетание шести σ-связей с единой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром.
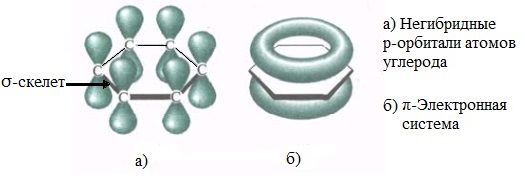
π-Электронное облако обусловливает сокращение расстояния между атомами углерода.
Все связи С-С в бензоле равноценны, их длина равна 0,140 нм, что соответствует промежуточному значению между длиной простой связи (0,154 нм) и двойной (0,134 нм). Это означает, что в молекуле бензола нет чередования простых и двойных связей, а существует особая связь – «полуторная» – промежуточная между простой и двойной, так называемая ароматическая связь.
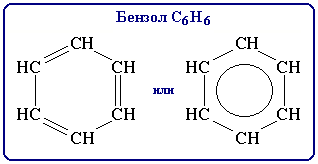
Поэтому структурную формулу бензола изображают в виде правильного шестиугольника (σ-скелет) с окружностью внутри, обозначающего делокализованные π-связи.
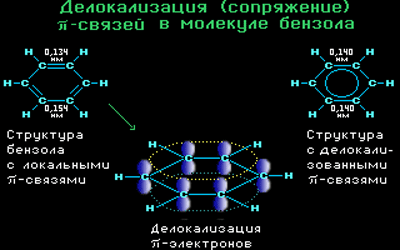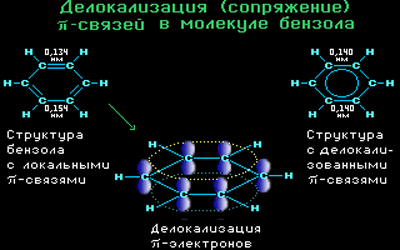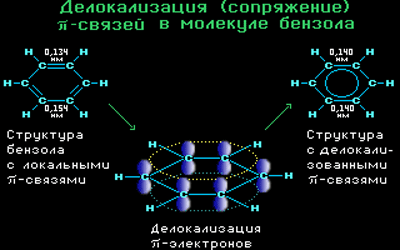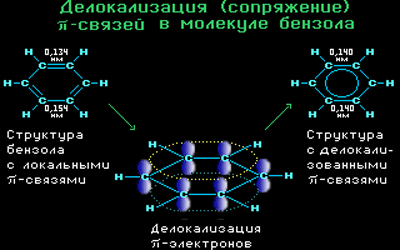
Такое электронное строение объясняет все особенности бензола. Становится понятно, почему бензол трудно вступает в реакции присоединения – это приводит к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
Таким образом, наряду с формулой Кекуле используется формула бензола, где обобщенное электронное облако изображают замкнутой линией внутри кольца.
Рубрики: Арены Теги: Арены
Бизнес и финансы
БанкиБогатство и благосостояниеКоррупция(Преступность)МаркетингМенеджментИнвестицииЦенные бумагиУправлениеОткрытые акционерные обществаПроектыДокументыЦенные бумаги — контрольЦенные бумаги — оценкиОблигацииДолгиВалютаНедвижимость(Аренда)ПрофессииРаботаТорговляУслугиФинансыСтрахованиеБюджетФинансовые услугиКредитыКомпанииГосударственные предприятияЭкономикаМакроэкономикаМикроэкономикаНалогиАудитМеталлургияНефтьСельское хозяйствоЭнергетикаАрхитектураИнтерьерПолы и перекрытияПроцесс строительстваСтроительные материалыТеплоизоляцияЭкстерьерОрганизация и управление производством
Опасность и меры предосторожности
Бензол легко воспламеняется. Пары бензола ядовиты при вдыхании, симптомы острого отравления проявляются только при относительно высоких концентрациях. Легкое отравление проявляется головокружением, тошнотой, сонливостью и апатией. Тяжелое отравление приводит к повышению температуры и нарушению зрения, вплоть до временной слепоты и потери сознания. Так называемая бензольная зависимость, которая может возникнуть при вдыхании бензола, приводит к чувству опьянения и эйфории. Бензол может быть смертельным при длительном воздействии.
Длительное употребление небольшого количества бензола в основном приводит к повреждению внутренних органов и костного мозга. Последнее приводит к снижению количества эритроцитов (анемия), что проявляется в сердцебиении, мерцании глаз, усталости, головокружении, бледности и головной боли. Бензол хранится в головном мозге, костном мозге и жировой ткани, медленно выводится через почки. Острая летальная доза (пероральная) для человека составляет 50 миллиграммов на килограмм. Бензол образует взрывоопасные смеси при объемной долей воздуха от 1,4 до 8%.
С бензолом следует обращаться с особой осторожностью, хранить при температуре от 15 C до 25 C.
Использует
Бензол используется в основном как промежуточный продукт для производства других химикатов, прежде всего этилбензола , кумола , циклогексана , нитробензола и алкилбензола. Более половины всего производимого бензола перерабатывается в этилбензол, предшественник стирола , который используется для производства полимеров и пластиков, таких как полистирол и пенополистирол. Около 20% производимого бензола используется для производства кумола, который необходим для производства фенола и ацетона для смол и клеев. Циклогексан потребляет около 10% мирового производства бензола; в основном он используется при производстве нейлоновых волокон, которые перерабатываются в текстиль и инженерные пластмассы. Меньшие количества бензола используются для производства некоторых типов каучуков , смазок , красителей , моющих средств , лекарств , взрывчатых веществ и пестицидов . В 2013 году крупнейшим потребителем бензола был Китай, за ним следовали США. Производство бензола в настоящее время расширяется на Ближнем Востоке и в Африке, тогда как производственные мощности в Западной Европе и Северной Америке стагнируют.
Толуол в настоящее время часто используется вместо бензола, например, в качестве присадки к топливу. Свойства этих двух растворителей схожи, но толуол менее токсичен и имеет более широкий диапазон жидкостей. Толуол также перерабатывается в бензол.
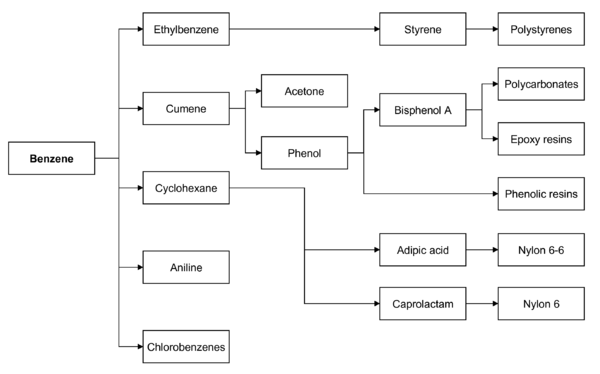
Основные химические вещества и полимеры, получаемые из бензола. При нажатии на изображение загружается соответствующая статья.
Компонент бензина
В качестве присадки к бензину (бензину) бензол увеличивает октановое число и снижает детонацию . Как следствие, бензин часто содержал несколько процентов бензола до 1950-х годов, когда тетраэтилсвинец заменил его в качестве наиболее широко используемой антидетонационной присадки. С глобальным отказом от этилированного бензина, бензол вернулся в качестве присадки к бензину в некоторых странах. В Соединенных Штатах опасения по поводу его негативного воздействия на здоровье и возможность попадания бензола в грунтовые воды привели к строгому регулированию содержания бензола в бензине, обычно с пределами около 1%. Европейские спецификации бензина теперь содержат такое же ограничение на содержание бензола в размере 1%. В 2011 году Агентство по охране окружающей среды США ввело новые правила, согласно которым содержание бензола в бензине снизилось до 0,62%. Во многих европейских языках слово «нефть» или «бензин» является родственным словом «бензол».
Применение бензола
В настоящее время бензол применяется во многих областях нашей жизни.
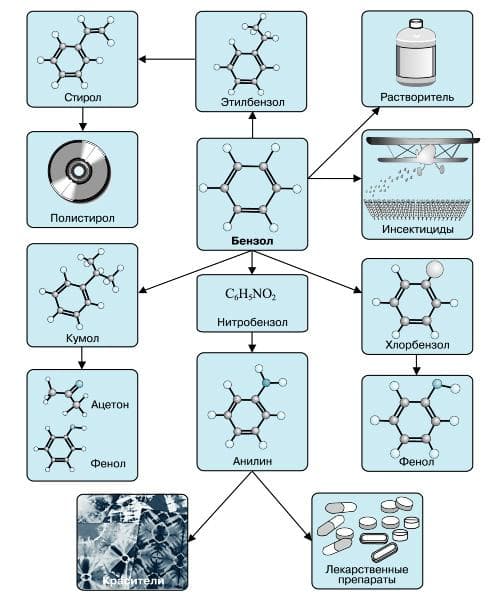
Наиболее часто данный углеводород применяется для синтезирования иных органических веществ. Используя реакцию нитрирования получают нитробензол; хлорирования — хлорбензол (растворитель), и другие вещества.
Хлорбензол часто используется в сфере сельского хозяйства, поскольку он является прекрасным средством для защиты растений. Данным веществом, при замене в его структуре молекул водорода молекулами хлора, протравливают семена растений, чтобы защитить их от грызунов и насекомых.
В области химической промышленности бензол играет немаловажную роль. Помимо его участия при создании других веществ, он также выступает в качестве растворителя. С помощью бензола возможно растворить любое органическое соединение.
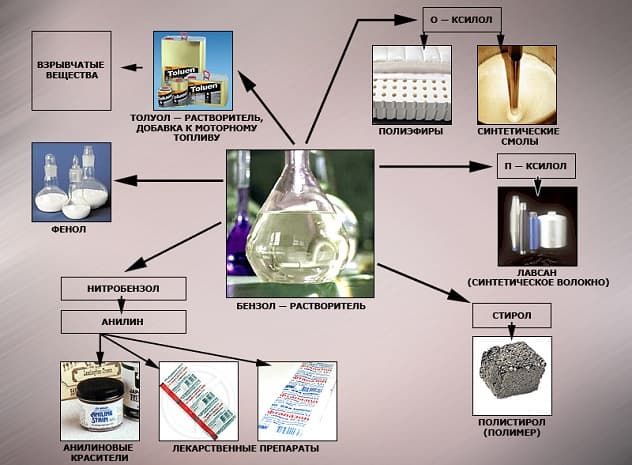
Сегодня этот углеводород чаще всего используется при синтезировании этилбензола и кумола. Однако он редко применяется в чистом виде. В основном используются его производные компоненты. Этилбензол успешно применяется в качестве одного из компонентов автомобильного топлива, а также для синтезирования ионообменной смолы.
Помимо сельскохозяйственной и химической промышленности, бензол успешно применяется в области медицины.
Впервые бензол начали применять для лечения такого заболевания, как белокровие. В начале 20 века медики всего земного шара использовали бензол для лечения лейкемии, однако вскоре выяснилось, что вылечить эту болезнь таким методом нельзя.
Сначала бензол принимали перорально, затем стали вводить в качестве инъекции. Такое его применение было связано с тем, что первоначальные исследования показали возможность данного вещества снижать уровень лейкоцитов в крови, но вскоре выяснилось, что его применение в этих целях очень опасно.
Предыдущая
ХимияВалентность химических элементов
Следующая
ХимияМеталлическая химическая связь — характеристика, способы образования и свойства