Аммиак ( нитрид водорода )
Содержание:
- Химические свойства
- 8 Выполнение измерений
- Библиография
- 4 Средства измерений, вспомогательные устройства, реактивы, материалы
- Аммиак, формула, газ, характеристики:
- Способы утилизации
- ПОЛУЧЕНИЕ АММИАКА
- Реакция — взаимодействие — аммиак
- Современное производство
- Производство метанола
- Сжигание аммиака и его каталитическое окисление кислородом
Химические свойства
-
- NH3 + H+ ⟶ NH4+.
Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
-
- NH3 + H2O ⟶ NH4+ + OH− , Ko=1,8⋅10−5.
Взаимодействуя с кислотами, даёт соответствующие соли аммония:
-
- NH3 + HNO3 ⟶ NH4NO3.
Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды, имиды и нитриды. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
-
- 2NH3 + 2K ⟶ 2KNH2 + H2.
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы OH− и NH2−, а также молекулы H2O и NH3 изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
-
- NaNH2 + H2O ⟶ NaOH + NH3.
и в спиртах:
-
- KNH2 + C2H5OH ⟶ C2H5OK + NH3.
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
-
- KNH2 ⇄ K+ + NH2− .
Фенолфталеин в этих растворах окрашивается в малиновый цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
При нагревании аммиак разлагается, проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
-
- 2NH3 →1200—1300∘C N2 + 3H2 (реакция обратима),
- 4NH3 + 3O2 ⟶ 2N2 + 6H2O (без катализатора, при повышенной температуре),
- 4NH3 + 5O2 ⟶ 4NO + 6H2O (в присутствии катализатора, при повышенной температуре).
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
-
- 3CuO + 2NH4Cl ⟶ 3Cu + 3H2O + 2HCl + N2.
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
-
- 2NH3 + NaOCl ⟶ N2H4 + NaCl + H2O.
- Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
- С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
-
- NH3 + CH3Cl ⟶ [CH3NH3]Cl (гидрохлорид метиламмония).
- С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
- При 1000 °C аммиак реагирует с углём, образуя синильную кислоту HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
-
- 2CH4 + 2NH3 + 3O2 ⟶ 2HCN + 6H2O,
- NH4OH ⟶ NH3 + H2O.
- C солями меди и с серебром образует комплексные соли-аммиакаты
-
- Cu(NO3)2 + 4NH3 ⟶ [Cu(NH3)4](NO3)2,
- Cu3(PO4)2 + 12NH3 ⟶ [Cu(NH3)4]3(PO4)2,
- Cu(CH3COO)2 + 4NH3 ⟶ [Cu(NH3)4](CH3COO)2,
- AgNO3 + 2NH3 ⟶ [Ag(NH3)2]NO3.
Колонна синтеза аммиака, построенная в 1921 году BASF в Оппау, ныне расположена при университете Карлсруэ.
8 Выполнение измерений
8.1 Выполнение измерений аммонийного азота без отгонки
Отмеряют цилиндром 50 см3 отфильтрованной анализируемой воды, помещают ее в сухую колбу вместимостью 100 см3, приливают 1 см3 раствора сегнетовой соли, перемешивают, затем добавляют 1 см3 реактива Несслера и опять хорошо перемешивают. Через 10 мин измеряют оптическую плотность проб на фотоэлектроколориметре с синим светофильтром или спектрофотометре (l = 440 нм) в кюветах с длиной поглощающего слоя 2 см против дистиллированной воды.
Одновременно с серией проб анализируемой воды проводят определение в холостой пробе, в качестве которой берут 50 см3 безаммиачной воды. Оптическую плотность холостой пробы вычитают из оптической плотности анализируемых проб.
Если массовая концентрация аммонийного азота в анализируемой, воде превышает 4,0 мг/дм3, то для определения берут аликвоту меньшего объема и доводят объем до 50 см3 безаммиачной водой.
Если анализируемая вода была законсервирована серной кислотой, после добавления раствора сегнетовой соли следует добавить 2 капли раствора NaOH 6 моль/дм3.
В присутствии активного хлора к пробе до прибавления реактивов приливают эквивалентное хлору количество раствора тиосульфата натрия. Содержание активного хлора должно быть определено заранее.
При анализе окрашенных вод вводят поправку на цветность. Для этого к другой порции анализируемой воды добавляют все реактивы кроме реактива Несслера, вместо которого приливают 1 см3 10 % раствора NaOH. Оптическую плотность полученного раствора вычитают из оптической плотности пробы. Если значение оптической плотности, обусловленное окраской пробы, превышает 0,3, следует использовать определение аммонийного азота после отгонки.
8.2 Выполнение измерений аммонийного азота с отгонкой
100 см3 анализируемой воды помещают в перегонную колбу, добавляют 40 см3 буферного раствора с рН 7,4 — 7,6 и отгоняют пробу в плоскодонную колбу вместимостью 100 см3, содержащую 10 см3 раствора серной кислоты 0,05 моль/дм3, до объема примерно 90 см3 (на колбе должна быть сделана соответствующая метка). Если проба была законсервирована серной кислотой, ее следует предварительно нейтрализовать с помощью раствора NaOH 6 моль/дм3 до рН 7 — 8 по универсальной индикаторной бумаге. При отгонке выходной отросток холодильника должен быть погружен в раствор серной кислоты. При необходимости его можно удлинить с помощью стеклянной трубки, пристыкованной к холодильнику с помощью резиновой трубки.
Для устранения влияния активного хлора, в колбу до отгонки следует добавить эквивалентное количество раствора тиосульфата натрия.
В присутствии сульфидов к пробе до отгонки добавляют 1 см3 раствора соли цинка.
После отгонки пробу из колбы-приемника переносят в мерную колбу вместимостью 100 см3, промывают трубку холодильника и колбу-приемник небольшим количеством безаммиачной воды и присоединяют промывную воду к пробе. Доводят раствор в колбе до метки безаммиачной водой и перемешивают. Далее отбирают 50 см3 отгона в коническую колбу и проводят определение аммонийного азота, как описано выше.
Холостой опыт выполняют аналогично, используя 100 см3 безаммиачной воды.
Библиография
Закусов В. В. Фармакология, с. 186, М., 1966; Козлов Н. Б. Аммиак, его обмен и роль в патологии, М., 1971; Машковский М. Д. Лекарственные средства, ч. 1, с. 393, М., 1972; Реми Г. Курс неорганической химии, пер. с нем., т. 1, с. 587, М., 1972; Goodman L. S. a. Gilman A. Pharmacological basis of therapeutics, N. Y., 1970.
Профессиональные вредности
Алпатов И. М. Изучение токсичности газообразного аммиака, Гиг. труда и проф. заболев., № 2, с. 14, 1964; Алпатов И. М. и Михайлов В. И. Исследование токсичности газообразного аммиака, там же, № 12, с. 51, 1963; Вольфовская Р. Н. и Давыдова Г. Н. Клинические наблюдения над острыми отравлениями аммиаком, Сб. науч. работ Ленингр. ин-та гиг. труда, с. 155, 1945; Вредные вещества в промышленности, под ред. Н. В. Лазарева, ч. 2, с. 120, Л., 1971, библиогр.; Михайлов В. И. и др. Влияние малых концентраций аммиака на некоторые биохимические и физиологические показатели у человека, Гиг. труда и проф.заболев., № 10, с. 53, 1969, библиогр.
4 Средства измерений, вспомогательные устройства, реактивы, материалы
4.1.1 Фотоэлектроколориметр типа КФК-2, КФК-2мп (КФК-3) по ТУ 3.3.1766, ТУ 3.3.1860 или спектрофотометр типа СФ-46 (СФ-26).
4.1.2 Весы аналитические 2 класса точности по ГОСТ 24104.
4.1.3 Весы технические лабораторные 4 класса точности по ГОСТ 24104 с пределом взвешивания 200 г.
4.1.4 Шкаф сушильный общелабораторного назначения по ГОСТ 13474.
4.1.5 Плитка электрическая с закрытой спиралью и регулируемой мощностью нагрева по ГОСТ 14919.
4.1.6 Колбы мерные не ниже 2 класса точности по ГОСТ 1770, вместимостью:
50 см3 — 2
100 см3 — 2
500 см3 — 1
4.1.7 Пипетки градуированные не ниже 2 класса точности по ГОСТ 29227 вместимостью:
1 см3 — 5
5 см3 — 1
10 см3 — 1
4.1.8 Пипетки с одной отметкой не ниже 2 класса точности по ГОСТ 29169 вместимостью:
5 см3 — 1
10 см3 — 1
4.1.9 Цилиндры мерные по ГОСТ 1770 вместимостью:
50 см3 — 2
100 см3 — 2
250 см3 — 1
1 дм3 — 1
4.1.10 Колбы конические или плоскодонные по ГОСТ 25336 вместимостью:
100 см3 — 7
500 см3 — 1
4.1.11 Воронка лабораторная по ГОСТ 25336 диаметром 3 — 4 см — 1
4.1.12 Установки для отгонки аммиака (колбы круглодонные термостойкие вместимостью 250 см3, каплеуловители с отводом, холодильники с прямой трубкой и колбы плоскодонные вместимостью 100 см3) по ГОСТ 25336 — 2
4.1.13 Стаканы химические термостойкие по ГОСТ 25336 вместимостью:
250 см3 — 1
1 дм3 — 1
4.1.14 Стаканчики для взвешивания (бюксы) по ГОСТ 25336 — 2
4.1.15 Колонка ионобменная d = 2 — 4 см и h = 50 — 60 см — 1
4.1.16 Эксикатор по ГОСТ 25336 — 1
4.1.17 Устройство для фильтрования проб с использованием мембранных или бумажных фильтров — 1
Допускается использование других типов средств измерений, посуды и вспомогательного оборудования, в том числе импортных, с характеристиками не хуже, чем у приведенных в .
4.2.1 Хлорид аммония NH4Cl по ГОСТ 3773, х.ч.
4.2.2 Реактив Несслера K2HgI4] · KOH или K2HgI4NaOH по ТУ 6-09-2089, ч.д.а или иодид калия KI по ГОСТ 4232, ч.д.а и иодид ртути (II) HgI2 по ТУ 6-09-02-375, ч.д.а.
4.2.3 Тартрат калия-натрия, тетрагидрат (сегнетова соль) KNaC4H4O6 · 4H2O по ГОСТ 5845, ч.д.а.
4.2.4 Калия дигидрофосфат КН2РО4 по ГОСТ 4198, ч.д.а.
4.2.5 Калия гидрофосфат тригидрат К2НРО4 · 3Н2О по ГОСТ 2493, ч.д.а.
4.2.6 Натрия гидроксид NaOH по ГОСТ 4328, ч.д.а.
4.2.7 Серная кислота H2SO4 по ГОСТ 4204, ч.д.а.
4.2.8 Соляная кислота HCl по ГОСТ 3118, ч.д.а.
4.2.9 Натрия карбонат Na2CO3 по ГОСТ 84, ч.д.а.
4.2.10 Натрия тиосульфат пентагидрат Na2S2O3 · 5H2O по ГОСТ 27068, ч.д.а.
4.2.11 Цинка сульфат гептагидрат ZnSO4 · 7H2O по ГОСТ 4174, ч.д.а. или цинка хлорид ZnCl2 по ГОСТ 4529, ч.д.а.
4.2.12 Катионит сильнокислотный КРС-5п-Т40 по ТУ 6-09-10-829 или другой, равноценный по характеристикам.
4.2.13 Вода дистиллированная по ГОСТ 6709.
4.2.14 Фильтры бумажные обеззоленные «синяя лента» по ТУ 6-09-1678.
4.2.15 Фильтры мембранные «Владипор МФА-МА», 0,45 мкм, по ТУ 6-05-1903 или другого типа, равноценные по характеристикам.
4.2.16 Универсальная индикаторная бумага по ТУ 6-09-1181. Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных, с квалификацией не ниже указанной в .
Аммиак, формула, газ, характеристики:
Аммиак – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак (NH3) – наиболее простое и устойчивое соединение азота с водородом.
Химическая формула аммиака NH3. Изомеров не имеет.
Строение молекулы аммиака:
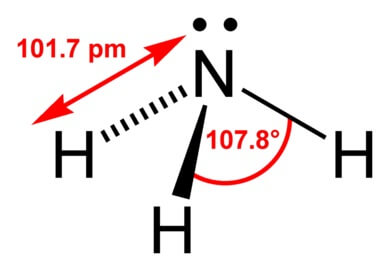
Форма молекулы аммиака напоминает тригональную пирамиду, в вершине которой расположен атом азота. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4+. Несвязывающее двухэлектронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Аммиак – при нормальных условиях бесцветный газ, с резким характерным запахом (запах «нашатырного спирта»).
Аммиак – токсичное горючее газообразное вещество, обладающее свойством образовывать при контакте с воздухом взрывоопасную смесь.
Легче воздуха. Плотность по сравнению с плотностью воздуха 0,59. Таким образом, аммиак практически вдвое (в 1,7 раза) легче воздуха. Его можно собирать в перевернутые вверх дном сосуды.
Аммиак – это горючий газ. Пожаро- и взрывоопасен. В чистом кислороде аммиак сгорает бледно-желтым пламенем, превращаясь, в основном, в азот и воду. Аммиак горит при наличии постоянного источника огня. Наличие масел и другого горючего увеличивает пожаровзрывоопасность этого вещества.
Аммиак образует с воздухом взрывоопасную смесь. Концентрационные пределы распространения пламени – 15,0-33,6 объемные доли, %; либо 107-240 г/м3. Наиболее легковоспламеняемая концентрация 24,5% (180 г/м3).
Хорошо растворим в воде как в газообразном, та и в жидком состоянии. Растворимость NH3 в воде чрезвычайно велика – около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. При растворении аммиака в воде выделяется значительное количество тепла.
Водный раствор аммиака имеет сильную щелочную реакцию вследствие образования гидроокиси аммония NH4OH.
Аммиак относится к токсичным веществам, к IV классу опасности (малоопасные вещества) по ГОСТ 12.1.007. ПДК аммиака в атмосферном воздухе населенных мест по ГОСТ 6221-90 составляет: максимально разовая – 0,2 мг/м3; среднесуточная – 0,04 мг/м3. Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения (ПДКр.з.) по ГОСТ 12.1.005-88 составляет 20 мг/м³. Ощущение запаха аммиака свидетельствует о превышении допустимых норм, т.к. запах аммиака ощущается при концентрации 37 мг/м³.
Аммиак по физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Аммиак в следовых количествах содержится в природе и планетах Солнечной системы. Почки человека выделяют аммиак для нейтрализации избыточной кислоты.
Ежегодное мировое промышленное производство аммиака составляет более 180 млн тонн. Он относится к числу важнейших продуктов химической промышленности. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Способы утилизации
Утилизировать аммиачные отходы непросто. Процесс требует профессионального подхода и определенных денежных вложений. Выделяют следующие основные способы утилизации аммиака жидкого технического:
- селективный, следуя которому получают компоненты, готовые к вторичному использованию;
- переработка отхода с целью получения сырьевой базы для производства других новых материалов.
Рассмотрим пути утилизации аммиака на примере нашатырного спирта. Это химическое вещество переработать довольно трудно. Единственное, что из него можно произвести, это удобрения. Процесс переработки происходит по стадиям:
- большие объемы аммиачного раствора помещаются в специальные резервуары для обеспечения безопасного хранения;
- затем отход нейтрализуют, используя при этом разные методы регенерации;
- далее выделяют вещества, обладающие потенциальной полезностью, и получают неопасные жидкости;
- осуществляют реализацию вторичной продукции (при условии, если ее производство является возможным).
Все этапы утилизации должна осуществлять лицензированная компания, способная произвести экологически безопасный процесс и выдать клиенту пакет необходимых документов. Однако невозможность получать дорогой вторичный продукт, дороговизна перевозки и самой переработки обеспечивает необходимость вносить плату заказчиком за утилизацию его отходов.
ПОЛУЧЕНИЕ АММИАКА
В небольших количествах аммиак встречается в морской и речной воде, воздухе, почве и атмосферных осадках.
В лабораторных условиях аммиак чаще всего получают действием гидроксида кальция (гашёной извести) на хлорид аммония, в ходе реакции:
Ca(OH)2 + 2 NH4Cl = CaCl2 + 2 NH3 + 2 Н2О.
В промышленности аммиак получают в значительных объёмах следующими способами:
- Способ Габера (Германия, 1913 год) — смесь водорода и азота нагревают до 600° C под давлением в 200 атмосфер в присутствии окиси железа (в качестве катализатора); выход аммиака до 25%;
- Способ Клода (Франция, 1922 год) — реакция проводится при 360° C и давлением в 100 атмосфер, затем температура самоподдерживается в ходе реакции и, напротив, реактор охлаждается расплавленным свинцом; выход аммиака до 97%;
- Способ Франка и Каро (США, 1895 год) состоит в получении при 700° C из карбида кальция и азота (в присутствии катализатора) цианамида кальция CaCN2, применяемого как удобрение, а также выделяющего аммиак при разложении водой при нагреве;
- Способ Серпека заключается в получении нитрида алюминия (алюмонитрида AlN), который при действии на него водяного пара выделяет аммиак;
- Наиболее старый способ заключался в насыщении серной или соляной кислотой воды после промывки светильного газа (продукта сухой перегонки дерева) на газовых заводах.
Реакция — взаимодействие — аммиак
Реакция взаимодействия аммиака с кислородом также является реакцией окисления, так как водород отнят от вещества, в результате чего образовались азот и вода.
Реакция взаимодействия аммиака, кислорода и пропилена в зависимости от типа применяемого катализатора заканчивается через 0 1 — 50 сек. В промышленных процессах время пребывания реакционной смеси в зоне реакции составляет 1 — 15 сек.
Реакцию взаимодействия аммиака и окиси этилена проводят при давлении 7 — 10 МПа, температуре 90 — 130 С и в присутствии небольшого количества воды, выполняющей роль катализатора в данном процессе.
Практически реакция взаимодействия аммиака с галогенспроизвод-ным не останавливается на образовании первичного амина, а идет дальше и получается смесь всех четырех аминов.
Практически реакция взаимодействия аммиака с галогенопро-изводным не останавливается на образовании первичного амина, а идет дальше и получается смесь всех четырех аминов.
Практически реакция взаимодействия аммиака с галогенопроизводным не останавливается на образовании первичного амина, а идет дальше и получается смесь всех четырех аминов. Далее производят разделение смеси, например, фракционной перегонкой, когда температуры кипения продуктов значительно отличаются одна от другой.
Практически реакция взаимодействия аммиака с галогенопроизвод-ным не останавливается на образовании первичного амина, а идет дальше и таким образом получается смесь всех четырех аминов. Далее производят разделение смеси, например, фракционной перегонкой, когда температуры кипения продуктов значительно отличаются одна от другой.
На заводах реакция взаимодействия аммиака с серной кислотой осуществляется в аппаратах-сатураторах. Сатураторы изготовляют из листового железа или деревянных досок и внутри выкладывают листовым свинцом.
|
Получение аммиака. |
Написать уравнения реакций взаимодействия аммиака с кислотами: а) соляной, б) азотной, в) серной, г) угольной, д) фосфорной.
Итак, в реакции взаимодействия аммиака с водой к молекуле аммиака присоединяется протон из воды, в результате образуется катион аммония NHJ. Химическая связь в катионе аммония — ковалентная, возникшая по донорно-акцепторному механизму ( стр.
В заводских условиях реакция взаимодействия аммиака с серной кислотой по мокрому способу осуществляется в аппаратах, называемых сатураторами, в которых газообразный аммиак бар-ботирует через слой серной кислоты.
В основу метода положена реакция взаимодействия аммиака с фенолятом натрия в присутствии гипохлорита натрия. Вероятно, реакция протекает через образование я-аминофенола с последующим превращением этого соединения в галогенпроизводное хинонимина и, наконец, в соединение индофенольного типа. Максимальная оптическая плотность комплекса наблюдается при 625 нм.
Первая стадия этой реакции аналогична реакции взаимодействия аммиака с асимметричным дихлордифторэтиленом с образованием дихлорацетонитрила.
На основании опытных данных определены значения констант скоростей реакций взаимодействия аммиака с NO и NO2 в присутствии воды.
Современное производство
Система работы любого аммиачного завода достаточно сложная и содержит в себе нескольких этапов. Технология получения искомого вещества осуществляется в 6 этапов. В процессе проведения синтеза происходит получение, собирание и распознавание аммиака.
Первоначальная стадия заключается в извлечении серы из природного газа при помощи десульфуратора. Эта манипуляция требуется вследствие того, что сера является каталитическим ядом и убивает никелевый катализатор еще на стадии извлечения водорода.

На втором этапе проходит конверсия метана, которая протекает с применением высокой температуры и давления при использовании никелевого катализатора.
На третьей стадии случается частичное выгорание водорода в кислороде воздуха. В результате производится смесь водяного пара, оксида углерода, а также азота.
На четвертом этапе происходит реакция сдвига, которая проходит при различных катализаторах и двух отличных температурных режимах. Первоначально применяется Fe3O4, и процесс протекает при температуре 400 ˚С. Во второй стадии участвует более эффективный по своему воздействию медный катализатор, что позволяет осуществление производства при низких температурах.
Следующая пятая стадия предполагает избавление от ненужного оксида углерода (VI) из смеси газа путем применения технологии поглощения раствором щелочи.
На завершающем этапе оксид углерода (II) удаляется при использовании реакции конверсии водорода в метан через никелевый катализатор и большую температуру.
Полученная в результате всех манипуляций смесь газа содержит 75 % водорода и 25 % азота. Ее сжимают под большим давлением, а затем остужают.
Именно эти манипуляции описывает формула выделения аммиака:
Хоть этот процесс выглядит не очень сложным, однако все вышеперечисленные действия по ее осуществлению говорят о сложности получения аммиака в промышленном масштабе.
На качество конечного продукта влияет отсутствие в сырье примесей.
Пройдя долгий путь от небольшого лабораторного опыта до масштабного производства, получение аммиака на сегодняшний день является востребованной и незаменимой отраслью химической промышленности. Этот процесс постоянно совершенствуется, обеспечивая качество, экономичность и необходимое количество продукта для каждой ячейки народного хозяйства.
Производство метанола
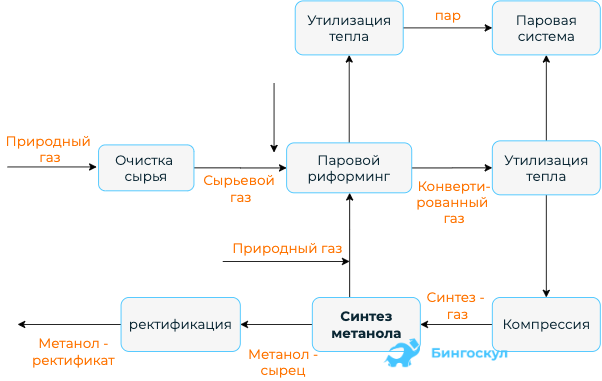
Для производства метанола используется реакция взаимодействия угарного газа и водорода. Технологическая цепочка практически повторяет ту, что используется для получения аммиака. Схожесть обусловлена частичным сходством проходимых реакций. И аммиак, и метанол – это экзотермические, обратимые, каталитические реакции, процесс протекания которых предусматривает уменьшение объема газообразных веществ.
Для синтеза метанола используются следующие приёмы:
- Применение в колонне синтеза катализатора.
- Использование высокого давления, повышающего уровень выхода продукта.
- Принципы теплообмена и циркуляции.
- Для увеличения скорости реакции используется высокая температура.
Сжигание аммиака и его каталитическое окисление кислородом

Окисление аммиака кислородом имеет определенные особенности. Существует два различных типа окисления: каталитический (с катализатором), быстрый (горение).
При горении происходит окислительно-восстановительная реакция, продуктами которой являются молекулярный азот и вода: 4NH3 + 2O2 = 2N2 + 6H2O (пламя желто-зеленое, горение начинается при 651 или 103,8 градусов по Фаренгейту, так как это температура самовоспламенения аммиака). Каталитическое окисление кислорода также происходит при нагревании (около 800 ᵒC или 1472 ᵒF), но один из продуктов реакции отличается: 4NH₃ + 5O₂ = 4NO + 6H₂O (в присутствии платины или оксидов железа, марганца, хрома или кобальта в качестве катализатора продуктами окисления являются оксид азота (II) и вода).
Рассмотрим однородное окисление аммиака кислородом. Бесконтрольная однотипная оксидация участка газа аммиака — относительно медленная реакция. О ней не сообщается подробно, но нижний предел воспламеняемости аммиачно-воздушных смесей при 25 оС составляет около 15 % в интервале давлений 1-10 бар и уменьшается по мере повышения начальной температуры газовой смеси.
Если CNH~ — это молевая доля NH3 в смеси воздух-аммиак с температурой tmixed (OC), то из данных CNH = 0.15-0 следует, что предел воспламеняемости низкий. Поэтому разумно работать с достаточным запасом прочности ниже нижнего предела воспламеняемости, как правило, данные о смешивании аммиака с воздухом часто далеки от совершенства.