Чем опасно отравление нашатырным спиртом?
Содержание:
- Нашатырь в медицине
- История
- Жидкий аммиак
- История появления аммиака
- В промышленности
- Аммиак как растворитель.
- Применение аммиака в промышленности и сельском хозяйстве
- Строение ядра и электронных оболочек.
- Роль гидроксида аммония в биологических системах
- Действия человека при отравлении аммиаком, а также превентивные меры.
- Химически вредные вещества и их влияние на организм человека
- Аммиак, жидкость, твердое тело, характеристики:
- Применение нашатырного спирта
- Инструкция по применению
- Нашатырный спирт – формула, происхождение
Нашатырь в медицине
- Это возможно благородя едким щелочным свойствам нашатыря.
- Нашатырный спирт в современной медицине- это 10% раствор гидроксида аммония.
- Нашатырь известен способностью к возбуждению дыхательных и сосудодвигательных центров мозга, благодаря его резкому и не очень приятному запаху. Если переборщить, можно вызвать остановку дыхания. Столетия нашатырь применялся как средство от обморока.
- При лечении бронхитов иногда назначают нашатырно-анисовым капли, как отхаркивающее.

- Людям, которые страдают от бронхитов, рекомендуется прием нашатырно-анисовых капель (в качестве отхаркивающего средства)
- Нашатырь может стать решением такой специфической проблемы как продолжительное чихание. Защитная реакция организма на простудные заболевания может очень розниться. Иногда чихание может стать для человека изнурительным испытанием, когда человек не может перестать чихать на протяжении 10 минут. Если дать чихающему понюхать нашатырь, он успокоится и сможет спокойно вздохнуть.
- Нашатырь хорошо помогает и при насморке. Так как использовать его придется не единожды, лучше приготовить раствор особым способом: напомнить небольшой флакон нашатырных спиртом, оставив несколько миллиметров пространства сверху и долить растительным маслом. Таким образом масло будет закрывать нашатырь от испарения, сохраняя его. Перед использование флакон нужно взболтать.
- При возникновении насморка или навязчивого чиха нужно поднести открытый флакон к каждой ноздре поочередно, зажимая другую часть носа. Не стоит сразу делать глубокие вдохи, можно получить чувство похожее на удар.
- От боли в суставах можно приготовить более специфическое средство.
- Смешайте ложку нашатыря и три ложки воды с мукой. Приложите полученное тесто к больному месту. Боли от остеохондроза успокоит растирание настойкой нашатыря и красного перца 5:1.
- От полиартрита готовят примочки из меда, нашатырного спирта, йода, глицерина и медицинской желчи. Нужно приложить к пораженному месту на сутки.
- Бронхиальную астму облегчает напиток из молока с несколькими каплями нашатыря. Его нужно месяц пить перед едой. При приступах можно пить такое молоко теплым каждые 2 часа, пока кашель не успокоится.
- Нашатырный спирт, смешенный с глицерином в пропорции 1:2 помогает при пролежнях. После обработки и высыхания место нанесения нужно присыпать детской посыпкой.
- Настой нашатырного спирта и семян дурмана помогает от эндемического зоба. Настойку нужно наносить на горло в течении 10 дней и укутывать теплым платком.
- Смесь из 1мл гидроксида аммония, 2 мл уксусной кислоты, 1 мл салициловой кислоты, 30 мл камфорного спирта, 5 гр серы на основе 50 мл медицинского спирта помогает от пяточной шпоры.
- Если протереть ячмень небольшим количеством нашатыря, он сойдет не созревая.
История
Аммиак был впервые выделен в чистом виде Дж. Пристли в 1774 году, который назвал его «щелочной воздух» (англ. alkaline air). Через одиннадцать лет, в 1785 году К. Бертолле установил точный химический состав аммиака. С того времени в мире начались исследования по получению аммиака из азота и водорода. Аммиак был очень нужен для синтеза соединений азота, поскольку получение их из чилийской селитры ограничивалось постепенным истощением запасов последней. Проблема уменьшения запасов селитры обострилась к концу XIX века. Только в начале XX века удалось изобрести процесс синтеза аммиака, пригодный для промышленности. Это осуществил Ф. Габер, начавший трудиться над этой задачей в 1904 году и к 1909 году создавший небольшой контактный аппарат, в котором использовал повышенное давление (в соответствии с принципом Ле-Шателье) и катализатор из осмия. 2 июля 1909 года Габер устроил испытания аппарата в присутствии К. Боша и А. Митташа, оба — от Баденского анилинового и содового завода (BASF), и получил аммиак. К. Бош к 1911 году создал крупномасштабную версию аппарата для BASF, а затем был построен и 9 сентября 1913 года вступил в строй первый в мире завод по синтезу аммиака, который был расположен в Оппау (ныне район в черте города Людвигсхафен-на-Рейне) и принадлежал BASF. В 1918 году Ф. Габер стал лауреатом Нобелевской премии по химии «за синтез аммиака из составляющих его элементов». В России и СССР первая партия синтетического аммиака была получена в 1928 году на Чернореченском химическом комбинате.
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявляется его сходство с водой:
-
- 2NH3 ⟶ NH4+ + NH2−.
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. В отличие от воды с жидким аммиаком данные металлы не реагируют, а именно растворяются и могут быть выделены в исходном виде при испарении растворителя. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например, Na4Pb9.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6], обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворённый в NH3 металл постепенно реагирует с образованием амида:
-
- 2Na + 2NH3 ⟶ 2NaNH2 + H2 .
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической проводимостью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окружённые молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
История появления аммиака
Впервые аммиак получил в 1774 году английский химик Джозефом Пристли. Открытый им газ получил название “щелочного воздуха”, так как химический состав химик, а одновременно и священник, определить не смог. Лишь спустя 11 лет (в 1785 году) Клод Луи Бертолле — известный французский химик определил химический состав газа и назвал его аммиаком (NH3).
На счет того, почему газ назвали именно так, имеется две версии:
- одну связывают с именем бога древних египтян — Амоном;
- вторую — со сходным по звучанию оазиса в районе северной Африки — “Аммона”.

По первой версии, люди, поклоняющиеся богу Амону, во время обряда нюхали нашатырный спирт.
Согласно второй — в оазисе Аммона, который находится на перекрестке караванных путей, из-за нахождения огромного количества вьючных животных, скапливались продукты их жизнедеятельности. При условиях жаркого климата мочевина имеет свойство быстро разлагаться и выделять газ, названный аммиаком.
Какая из двух версий достоверная и правильная — неизвестно и по сей день.

В промышленности
Аммиак промышленным путём получают из азота, соединяя его с водородом. Азот берут из воздуха, водород – из воды. Впервые метод разработал немецкий химик Фриц Габер. Промышленный способ получения аммиака стали называть процессом Габера.
Реакция проходит с уменьшением объёма и выделением энергии в виде тепла:
3H2 + N2 → 2NH3 + Q.
Реакция обратима, поэтому необходимо соблюсти несколько условий. При высоком давлении и низких температурах объём полученного аммиака увеличивается. Однако низкие температуры замедляют скорость реакции, а повышение температуры способствует увеличению скорости обратной реакции.
Опытным путём были найдены необходимые условия для проведения реакции:
- температура – 500°C;
- давление – 350 атм;
- катализатор – оксид железа Fe3O4 (магнетит) с примесями оксидов серебра, калия, кальция и других веществ.
При таких условиях получившийся газ содержит 30 % аммиака. Чтобы избежать обратной реакции, вещество быстро охлаждают. При низких температурах получившийся газ превращается в жидкость. Неизрасходованные газы – азот и водород – возвращаются обратно в колонну для синтеза. Такой способ помогает быстро получить большие объёмы аммиака, максимально используя сырьё.
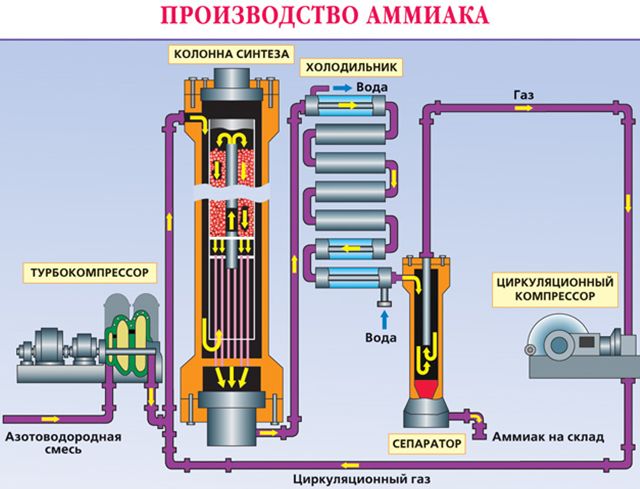
Рис. 1. Получение аммиака промышленным путём.
Чтобы найти нужный катализатор, было испробовано 20 тысяч разных веществ.
Аммиак как растворитель.
Высокая диэлектрическая проницаемость и дипольный момент жидкого аммиака позволяют использовать его как растворитель для полярных или ионных неорганических веществ. Аммиак-растворитель занимает промежуточное положение между водой и органическими растворителями типа этилового спирта. Щелочные и щелочноземельные металлы растворяются в аммиаке, образуя темносиние растворы. Можно полагать, что в растворе происходит сольватация и ионизация валентных электронов по схеме
Синий цвет связывают с сольватацией и движением электронов или с подвижностью «дырок» в жидкости. При высокой концентрации натрия в жидком аммиаке раствор принимает бронзовую окраску и отличается высокой электропроводностью. Несвязанный щелочной металл можно выделить из такого раствора испарением аммиака или добавлением хлорида натрия. Растворы металлов в аммиаке являются хорошими восстановителями. В жидком аммиаке происходит автоионизация
аналогично процессу, протекающему в воде:
Некоторые химические свойства обеих систем сопоставлены в табл. 4.
Жидкий аммиак как растворитель имеет преимущество в некоторых случаях, когда невозможно проводить реакции в воде из-за быстрого взаимодействия компонентов с водой (например, окисление и восстановление). Например, в жидком аммиаке кальций реагирует с KCl с образованием CaCl2 и K, поскольку CaCl2 нерастворим в жидком аммиаке, а К растворим, и реакция протекает полностью. В воде такая реакция невозможна из-за быстрого взаимодействия Ca с водой.
Применение аммиака в промышленности и сельском хозяйстве
Основная масса производимого в мире аммиака используется в сельском хозяйстве. Он применяется непосредственно в форме безводного аммиака или для производства различных азотсодержащих соединений, например повсеместно распространенного нитрата аммония.
Кроме того, аммиак часто используется в промышленных целях. Многие полезные азотсодержащие вещества производятся из дешевого и простого в получении аммиака, служащего источником азота. В частности, из аммиака получают гидразин, гидроксиламин, фенол, акрилонитрил, этаноламин, аммония бикарбонат, мочевину, а также многое другое.
Аммиак широко известен своими очищающими свойствами и часто используется в очистителях стекол. Благодаря противомикробным свойствам его применяют в качестве средства дезинфекции. Аммиак также используется в различных процессах ферментации.
Он может применяться в качестве хладагента и имеет маркировку «R717». Его практически перестали использовать с появлением хлорфторуглеводородов, в частности фреонов. Однако сейчас, когда стало известно о влиянии хлорфторуглеводородов на окружающую среду (об этом можно почитать, например, здесь), аммиак снова начинают применять в системах охлаждения.
Аммиак широко используется в промышленности, и сферы его применения настолько многообразны, включая обычные и редкие способы, что мы физически не сможем уместить весь список в эту статью. Обо всех многочисленных способах применения вещества можно почитать здесь.
По оценкам, в 2019 году в мире было произведено 140 млн тонн аммиака.
В интересующем нас регионе аммиак не является каким-то экзотическим импортируемым товаром. До войны в Сирии объемы производства аммиака оценивались в 104 000 тонн в год. Ирак производит более 300 000 тонн в год. Стоит отметить, что в большинстве случаев промышленное и коммерческое использование аммиака не требует каких-либо сверхтехнологий по современным стандартам химической промышленности. Его можно синтезировать буквально из воздуха при помощи технологии вековой давности, и для производства аммиака не нужны редкие природные ресурсы.
Строение ядра и электронных оболочек.
В природе существуют два стабильных изотопа азота: с массовым числом 14 ( содержит 7 протонов и 7 нейтронов) и с массовым числом 15 ( содержит 7 протонов и 8 нейтронов). Их соотношение составляет 99,635:0,365, поэтому атомная масса азота равна 14,008. Нестабильные изотопы азота 12N, 13N, 16N, 17N получены искусственно. Схематически электронное строение атома азота таково: 1s22s22px12py12pz1. Следовательно, на внешней (второй) электронной оболочке находится 5 электронов, которые могут участвовать в образовании химических связей; орбитали азота могут также принимать электроны, т.е. возможно образование соединений со степенью окисления от (–III) до (V), и они известны. См. также АТОМА СТРОЕНИЕ.
Роль гидроксида аммония в биологических системах
Данное вещество является важным источником азота для живых систем. Азот – химический элемент, необходимый для биосинтеза аминокислот. Гидроксид аммония применяется в промышленности для получения азотистых удобрений, необходимых для нормального роста и развития сельскохозяйственных культур.
В тканях человека и животных вследствие метаболизма образуется значительное количество аминокислот.
Высокие концентрации аммиака в тканях токсичны для организма. Печень преобразовывает гидроксид аммония в менее токсичный для организма продукт – мочевину.
Резкий «аромат» у людей способен возбуждать рецепторы носа и запускать возбудительные процессы, которые по нервным волокнам передаются в задний мозг.
В процессе пайки используется другое производное аммиака – его соль соляной кислоты, аммония хлорид. При высокой температуре он распадается с образованием паров аммиака и соляной кислоты в виде газа. Аммиак освобождает рабочую поверхность паяльника от оксидов металлов и частичек изделий, которые поддаются пайке.
Испарение аммиака – эндотермический процесс.
Диэлектрическая проницаемость, проводимость, вязкость и плотность жидкого NH3 ниже, чем у воды (вещество в 7 раз менее вязкое, чем вода), температура кипения вещества tкип -33,35°C, плавиться оно начинает при температуре -77,70°C
Вещество практически не пропускает электрический ток и растворяет многие органические и неорганические соединения.
В твердом виде NH3 имеет вид бесцветных кристаллов с кубической решеткой.
Разложение нитрида водорода на азот и водород становится заметным при температуре, превышающей 1200-1300°С, в присутствии катализаторов — при температуре выше 400°С.
На воздухе аммиак не горит, при прочих условиях, а именно в чистом кислороде, загорается и горит желто-зеленым пламенем.
Для удаления волос народная медицина рекомендует приготовить смесь следующего состава: 5 мл аммиачной воды, 35 мл 98 %-го этанола, 5 мл касторового масла и 1,5 мл спиртового раствора йода – все это следует тщательно перемешать для получения гомогенной массы. Полученное средство следует наносить на проблемные зоны с волосами два раза в день. Буквально через два-три дня вы получите желаемый результат.
Вред нашатырного спирта для человека проявляется при нарушении дозировки или неправильном применении препарата.
Превышение времени воздействия на нервные окончания приводит к излишнему раздражению, резким скачкам артериального давления, грозит прерыванием беременности.
При продолжительном контакте прижигает слизистые и кожу, что сопровождается гиперемией тканей, развитием отечности и болезненности.
Прием per os в малых концентрациях стимулирует секрецию желез, воздействуя на рвотный центр, рефлекторно повышает его возбудимость и вызывает рвоту.
В кровяное русло препарат не поступает.
Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.
Важно
При остром отравлении возможно развитие сердечной и легочной недостаточности со смертельным исходом. При первых же подозрениях на утечку аммиака следует вызвать специалистов.
Представители независимой экологической экспертизы «Экобаланс» имеют необходимое оборудование для того, чтобы определить уровень аммиака в воздухе.
Действия человека при отравлении аммиаком, а также превентивные меры.
Если
человек проживает рядом с аммиачными
производствами, то он должен сделать
следующее:
-
Запомнить
ближайшие предприятия, использующие
или производящие аварийно-химически
опасные вещества. Приобрести средства
индивидуальной защиты на всех членов
семьи. Узнать порядок оповещения о
возможных авариях на этих предприятиях,
например по телефону 01. -
Научиться
использовать подручные материалы для
защиты органов дыхания (изготовление
ватно-марлевой повязки, пропитанной
2% раствором пищевой соды). Продумать
необходимость герметизации оконных и
дверных проемов, вентиляционных люков. -
Определить
свои действия в случае эвакуации. С
собой необходимо брать аптечку, одежду,
документы, питание, деньги. -
Рассказать
детям, что надо делать, когда возникнет
авария и взрослых не окажется рядом. -
Научиться
оказывать первую медицинскую помощь
пострадавшим и научить всех членов
семьи.
При
оказании первой медицинской помощи при
отравлении аммиаком необходимо: надеть
на пострадавшего противогаз или
ватно-марлевую повязку, предварительно
смочив ее водой или 5%-ным раствором
лимонной кислоты; вынести пострадавшего
из очага заражения на чистый воздух,
обеспечить тепло и покой, теплое обильное
питье ( например: чай, молоко ), промыть
в течение 15 мин открытые участки тела
проточной водой, а глаза — 2 %-ным раствором
борной кислоты; в глаза закапать 2-3 капли
30% альбуцида, в нос – теплое растительное
масло, при спазме гортани — горчичный
или согревающий компресс на шею, горячие
ножные ванны; полоскание горла раствором
пищевой соды, доставка пострадавшего
в медицинское учреждение.
Острые
отравления аммиаком возможны при чистке
выгребных ям, канализационных труб, в
производстве натрия гидрокарбоната,
азотной кислоты, искусственных удобрений,
органических красителей, сахара и т. д.
В
легких случаях отравление характеризуется
раздражением носоглотки и глаз, чиханьем,
сухостью и першением в горле, охриплостью,
кашлем и болью в груди.
При
отравлении средней тяжести наблюдаются
следы ожога слизистой оболочки носоглотки
— жгучая боль в горле, сильный кашель,
чувство удушья. Возможно развитие отека
гортани. Могут быть симптомы раздражения
глаз (конъюнктивит), желудочно-кишечного
тракта (слюнотечение, тошнота, рвота,
боли в животе); покраснение лица,
потливость и др.
В
тяжелых случаях — возбуждение, бред,
резкое расстройство дыхания и
кровообращения, задержка мочи, обширный
ожог дыхательных путей, глаз. Иногда
развиваются токсический бронхит,
пневмония, отек легких.
К
вышеперечисленным действиям при
отравлении аммиаком следует добавить:
вдыхание паров лимонной или уксусной
кислот; ингаляции 10% раствором ментола
в хлороформе; внутривенно или подкожно
1-2 мл 1% раствора морфина и 1 мл 0,1% раствора
атропина; режим молчания; ингаляции с
антибиотиками; в нос — сосудосуживающие
средства (3% раствор эфедрина); внутрь —
кодеин (0,015 г), этилморфин (0,01 г); мероприятия
по предупреждению отека легких;
внутривенно вводить 10 мл 10% раствора
хлорида кальция, 10 мл 40% раствора глюкозы
и 1 мл 0,1% раствора атропина; при удушье
— трахеотомия; в глаза закапывать каждые
2 ч 30% раствор сульфацил-натрия и 0,5%
раствор дикаина.
Химически вредные вещества и их влияние на организм человека
- боль в груди;
- помутнение сознания;
- нарушение мочеиспускание (задержка);
- отек голосовых связок.
Если эти симптомы проявились – срочно вызывайте Скорую и Спасателей. Если же симптомы отсутствуют или выражены слабо, а едва уловимый запах присутствует, мы советуем обратиться в независимую экологическую экспертизу.
В каких сферах чаще всего случается отравление аммиаком? Аммиак используется повсюду. Особенно осторожными нужно быть там, где этот продукт скапливается в больших количествах или возможен прямой контакт с ним.
был получен английским химиком и философом Джозефом Пристли в 1774 году.
Габер и Карл Бош, получившие за свои исследования Нобелевские премии.
— один из самых важных продуктов химической промышленности. Большая часть получаемого в промышленности аммиака идет на приготовление азотной кислоты, азотных удобрений, красителей.
Применяется аммиак и для получения взрывчатых веществ.
Широко используются водные растворы аммиака.
Как слабое летучее основание, он применяются в химических лабораториях и производствах.
С помощью аммиака получают пищевую соду. В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров, поэтому при обморочных состояниях или алкогольном отравлении пострадавшему дают вдыхать пары нашатырного спирта.
При пайке металлов используют хлорид аммония — нашатырь — NH4Сl. При высокой температуре нашатырь разлагается с образованием аммиака, который очищает поверхности паяльника и спаиваемого изделия от оксидов металлов.
Аммиак используется для охлаждения каналов энергоснабжения Международной космической станции (МКС), которые обеспечивают МКС электричеством.
Смесь аммиака с воздухом взрывоопасна.
Аммиак горит при наличии постоянного источника огня. Емкости могут взрываться при нагревании. Газообразный аммиак является токсичным соединением.
При его концентрации в воздухе рабочей зоны около 350 мг/куб.
Вызывает сильный кашель, удушье, при высокой концентрации паров — возбуждение, бред.
Первая медицинская помощь: промыть глаза и лицо водой, надеть противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.
При попадании аммиака в желудок надо выпить несколько стаканов теплой воды с добавлением одной чайной ложки столового уксуса на стакан воды и вызвать рвоту. Индивидуальная защита: изолирующий и фильтрующие противогазы марок М, КД, респиратор РПГ-67КД, при их отсутствии — ватно-марлевая повязка, смоченная 5% раствором лимонной кислоты, защитный костюм, резиновые сапоги, перчатки. Зону поражения необходимо изолировать.
В зону аварии входить только в полной защитной одежде.
При пожаре: убрать из зоны пожара, если это не представляет опасности, и дать возможность догореть. Не приближаться к горящим емкостям.
Охлаждать емкости водой с максимального расстояния. Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.
Материал подготовлен на основе информации РИА Новости и открытых источников
Возможны и отравления в быту, если емкость с нашатырным спиртом неплотно закрыта, этот газ поступает в воздух помещения.
Также можно получить интоксикацию во время ингаляции, когда ватку с нашатырным спиртом дают нюхать более 3-5 секунд, чтобы привести в чувство, снять обморок. В итоге эффект получается обратный. Иногда нашатырный спирт добавляют в воду для щелочных ингаляций при бронхите.
Предельно допустимая концентрация аммиака в воздухе рабочей зоны равна 20 мг/куб.
м. Аммиак опасен при вдыхании.
При остром отравлении аммиаком поражаются глаза и дыхательные пути, при высоких концентрациях возможен смертельный исход.
Вызывает сильный кашель, удушье, при высокой концентрации паров — возбуждение, бред. При контакте с кожей — жгучая боль, отек, ожег с пузырями.
Аммиак и его воздействие на организм человека Аммиак в переводе с греческого (hals ammoniakos) — амонова соль.
Аммиак — бесцветный газ с резким запахом, температура плавления — 80° С, температура кипения — 36° С, хорошо растворяется в воде, спирте и ряде других органических растворителей.
Синтезируют из азота и водорода.
Предлагаем ознакомиться: Считается ли приватизированная квартира совместно нажитым имуществом
В природе образуется при разложении азотсодержащих органических соединений. Чистый аммиак был получен английским химиком и философом Джозефом Пристли в 1774 году.
Аммиак, жидкость, твердое тело, характеристики:
Жидкий аммиак – бесцветная жидкость, сильно преломляющая свет.
Аммиак как жидкость является хорошим растворителем для очень большого числа органических, а также для многих неорганических соединений. В жидком аммиаке хорошо растворяются щелочные, щелочноземельные металлы, а также другие простые вещества, как, например, фосфор, йод, сера. Слабо растворяются в жидком аммиаке азотнокислые, хлористые и бромистые соли, а соли серной, угольной, уксусной и фосфорной кислот, как правило, нерастворимы.
Чистый жидкий аммиак является диэлектриком, поэтому способен к образованию на стенках сосудов статического электричества.
Сжиженный безводный аммиак относится к трудногорючим веществам.
Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Твёрдый аммиак внешне представляет собой снегообразную массу из кубических кристаллов правильной формы.
Применение нашатырного спирта
Средство представляет собой растворенный в воде аммиачный газ, который от природы обладает высокой токсичностью и очень ядовит. Нашатырь это аммиак, который не имеет отношения к обычным алкогольным спиртам, не вызывает привычного опьянения. Название получено от латинского spiritus, что означает испарение чего-либо.
Широко применяется нашатырный спирт в медицине для следующих целей:
- При нанесении на кожу в виде раствора снимает зуд после укусов насекомых.
- Резкий запах быстро выводит из обморочного состояния.
- Используется в хирургии для обеззараживания инструментов и поверхностей (в сочетании с другими антисептиками).
- В определенной пропорции помогает убрать последствия отравления алкоголем.
- Добавляется в целебные составы для массажа и растираний при травмах, растяжениях, невралгии.
Не все знают, для чего нужен нашатырь в повседневном быту:
- Отлично выводит пятна с одежды при взаимодействии с другими веществами.
- Используется для ухода за замшей и кожей.
- Добавляется в лакокрасочные изделия, растворители и составы для ремонта.
- Применяется в составе косметических и моющих средств (красок для волос, средства для мытья стекол).
- Помогает освежить внешний вид золотых изделий.
При правильном применении и дозировке нашатырь становится помощником по хозяйству, избавляет от бактерий
При использовании следует соблюдать меры предосторожности и дозировку, не оставлять на видном месте без присмотра
Инструкция по применению
Нашатырь выпускается в нескольких формах:
- стеклянные флаконы от 10 до 100 мл для наружного применения;
- ампулы по 1 мл (10% водный раствора аммиака).
Хранят препарат в затемненных прохладных местах. Годность ампулы составляет 5 лет, флаконов — 2 года.
Показания к применению препарата
- Ингаляционно — для возбуждения дыхания, а также для быстрого выведения человека из обморочного состояния.
- Наружно — при обработке рук в хирургической практике и для обеззараживания кожи, чтобы устранить зуд после укусов различных насекомых.
- Внутрь — исключительно как рвотное средство.

Фармакодинамика препарата
При вдыхании нашатырного спирта препарат воздействует на рецепторы верхних путей дыхательной системы. При этом задействован рефлекторно-дыхательный центр. Также препарат рефлекторно оказывает воздействие на работу сердца и тонус сосудов.
Во время применения препарата внутрь возбуждается рвотный центр, за счет чего становится возможным опорожнение органов пищеварительной системы от токсинов.
При нанесении на кожу препарата, осуществляется отвлекающее действие через кожные рецепторы. Препарат подавляет очаг возбуждения, снижает боль и напряжение мышц, купирует спазмы тканей. На месте соприкосновения с препаратом разражаются рецепторы кожи, что и провоцирует высвобождение активных веществ. Благодаря этому происходит расширение сосудов, ускоряется процесс регенерации и питания тканей, нормализуется отток метаболитов.

Правила применения
В медицинской практике часто используется такой спирт для оказания раздражающего воздействие на рецепторы слизистой носа при обмороках, а также алкогольных отравлениях. Чтобы правильно использовать препарат, придерживайтесь следующей инструкции:
- Для нормализации дыхания и приведения человека “в чувства” при обмороке, к ноздрям пациента поднесите кусочек ваты, смоченной раствором аммиака.
- При алкогольном отравлении можно дать потерпевшему выпить нашатырь, но только в разведенном виде. Пропорции: на стакан воды — 5-6 капель.
- Как отхаркивающее средство используйте нашатырно-анисовые капли. Этот комбинированный препарат включает в себя раствор аммиака, этиловый спирт и анисовое масло. Рекомендуемая дневная доза:
- Для взрослых — до 15 капель (не более 5 капель дважды-трижды в сутки).
- Детям до 1 года — максимум по 1 капле, можно до 2 раз в день.
- Для провоцирования рвоты используйте препарат в разведенном виде: 5-7 капель препарата на полстакана воды.
- Для мытья рук в хирургической практике средство также применяйте в разведенном виде: 25 мл препарата на 5 л кипяченой теплой воды.
- Мазь, изготовленную из нашатырного спирта и ланолина в равных количествах, применяют для купирования неприятных симптомов после укусов насекомых.

Меры предосторожности
- Вдыхание паров раствора аммиака, нашатырного спирта в больших количествах может спровоцировать остановку дыхания и нарушение сердечного ритма.
- Если препарат в больших концентрациях принять внутрь, то появятся следующие симптомы: боль в животе, расстройство работы кишечника, рвота, судороги.
- Если передозировка произошла при ингаляции, то возможны насморк, кашель, оттек гортани, остановка дыхания.
- При наружном применении передозировка чревата ожогами.

Первая помощь при отравлении:
- При отравлении аммиаком пострадавшего необходимо вынести на свежий воздух, горло, нос, рот тщательно промыть водой. Для большей эффективности в воду добавьте глютаминовую или лимонную кислоту.
- При пропадании препарата на открытый участок тела, обильно промойте поврежденную кожу водой и накройте повязкой. Применять любые мази в течение 24 часов не рекомендуется, а в дальнейшем проведите терапевтическую обработку такую же, как и при термических ожогах.
- Если аммиак, нашатырный спирт высокой концентрации, попал в пищеварительный тракт, то хорошенько промойте желудок. Пострадавшему дайте выпить несколько белков от яиц, ложку растительного масла, стакан молока. Если есть возможность — сделайте клизму.
- При попадании брызг аммиака в глаза, немедленно промойте их проточной водой. После этого нанесите на пораженное место на коже вазелиновое или оливковое масло и закапайте глаза 0,5 % раствором дикаина, а при необходимости накройте глаза повязкой.

Нашатырный спирт – формула, происхождение
Аммиак и нашатырный спирт – разные вещества, хотя в состав последнего входит аммиак. Грубо говоря, нашатырный спирт — это водный раствор аммиака, чаще встречается название гидроксид аммония. В состав входит десять процентов аммиака, и девяносто процентов воды. Встречается использование других пропорций, с более высокой концентрацией аммиака.
Формула нашатырного спирта – NH4OH. Это бесцветная смесь, обладает прозрачным цветом, легко испаряется. В процессе испарения выделяет едкий, специфический запах. Что интересно, если водный раствор аммиака замерзнет, резкий запах останется.
Если кто-то говорит, аммиак — это нашатырный спирт, то он не прав. Первый компонент — это газообразное вещество, второй – водный раствор аммиака. А нашатырь обладает твердой формой.
Три компонента отличаются формулой – аммиак (NH3), нашатырь (NH4Cl), нашатырный спирт (NH4OH). Можно выделить две похожие черты – едкий запах и схожесть названий. Этим объясняется то, что люди путают эти вещества.
Всем известно о применении нашатырного спирта в медицине, но многие хозяйки также используют раствор в быту. Первое упоминание об использовании водного раствора аммиака датируется еще 13 веком.
Выделяют два способа производства нашатырного спирта:
- Промышленный – сначала создается аммиачный газ, затем его растворяют в воде, получая водный раствор аммиака.
- Бытовой – покупается двадцатипятипроцентная аммиачная вода. Далее ее разводят водой до получения более слабого, десятипроцентного раствора.