20 примеров реакции горения основные моменты
Содержание:
- Топливо и его горение
- Отравление
- Условия, необходимые для возникновения и развития процесса горения
- Особенности горения жидкого топлива
- Расчет горения смеси природного и доменного газов.
- Инициация реакции
- Реакции разложения
- Услуги
- Оборудование
- Бизнес и финансы
- Что такое горение
- Удельная теплота сгорания некоторых горючих материалов
Топливо и его горение
Основным источником энергии для металлургической промышленности является топливо.
Под топливом понимают вещество, горение которого сопровождается выделением значительного количества тепла и которое отвечает следующим требованиям:
-
запасы должны быть достаточными для того, чтобы их было экономически выгодно добывать и попользовать;
-
продукты сгорания должны легко удаляться из зоны горения;
-
продукты сгорания должны быть безвредны для окружающего мира и самих тепловых устройств;
-
процесс горения должен быть легко управляем.
Этим требованиям отвечают органические соединения, содержащие углерод С и водород Н и их соединения.
Все виды топлива подразделяют на естественное и искусственное, каждое из которых в свою очередь подразделяются на твердое, жидкое, газообразное.
Химический состав топлива.
Топливо состоят из горючей массы и балласта. К горючим компонентам относятся С, Н, S (сера органическая и колчеданная). В состав топлива входят азот N (не горит, теплоноситель), кислород О (окисляет горючие компоненты).
Кроме этого в топливе всегда присутствуют вода и зола. Вода, содержащаяся в топливе, подразделяется на гигроскопическую, химически связанную и внешнюю, которая механически удерживается в топливе и теряется при сушке.
Зола – это негорючая минеральная часть топлива, состоящая из Al2O3, Fe2O3, Si2O3, CaO и др.
Элементарный анализ топлива.
|
Индекс |
Состав |
|||||
|
C |
H |
O |
N |
S |
A |
W |
|
О |
органическая масса |
|||||
|
Г |
горючая масса |
|||||
|
С |
сухая масса |
|||||
|
Р |
рабочая масса |
Состав рабочего топлива:
СР + HР + OР + NР + SР + AР + WР = 100%
Пересчет состава топлива с любой массы на рабочее топливо выполняется по одному из следующих выражений:
Теплота сгорания топлива.
Количество выделившегося тепла при сжигании топлива связано с химическим составом топлива.
Количество тепла, которое выделяется при сжигании единицы топлива, называется теплотой сгорания топлива Q. Ее размерности: кДж/кг (ккал/кг), кДж/м3 (ккал/м3) или кДж/кмоль (ккал/кмоль).
В технике различают высшую Qв и низшую Qн теплоту сгорания топлива. Под низшей теплотой сгорания понимают то количество тепла, которое выделяется при сжигании единицы топлива до продуктов полного сжигания при условии, что вода, содержащаяся в продуктах сгорания, находится в виде пара, охлажденного до 20оС.
Теплота сгорания топлива определяется по следующим формулам:
для твердого и жидкого топлива:
для газообразного:
,
где CP, HP, CO, H2 и т.д. – составляющие топлив, %;
4, 187кДж = 1ккал.
Условное топливо.
Для удобства планирования, учета и сравнения различных видов топлива введено понятие условного топлива, которое характеризуется низшей теплотой сгорания
.
Для перевода натурального топлива в условное находится эквивалент данного топлива:
для твердого и жидкого:
для газообразного:
.
Перерасчет расхода натурального топлива Вр на условное Ву осуществляется по формуле:
Газообразное топливо.
Газообразное топливо по сравнению с твердым и жидким топливом обладает следующими преимуществами:
-
возможностью лучшего смешения газа с воздухом и, следовательно, сжиганием с меньшим избытком воздуха;
-
легкостью подогрева перед сжиганием;
-
отсутствием золы;
-
транспортабельностью и удобством учета расхода газа;
-
простотой обслуживания горелочных устройств.
Недостатки: взрывоопасность, малая объемная масса (требуются большие емкости для хранения).
Природный газ – наиболее дешевое топливо. Его основным горючим компонентом является метан CH4 = 95%.
Искусственные газы:
-
коксовый газ – продукт коксования углей;
горючие компоненты – Н2 = 46-60%; СН4 = 20-30%; МДж/м3;
-
доменный (колошниковый) газ получают в процессе доменной плавки, содержит около 30% СО; МДж/м3.
Жидкое топливо.
Естественное жидкое топливо – нефть. Как топливо ее используют редко.
Искусственное жидкое топливо – это продукты переработки нефти: бензин, лигроин, керосин, газойль и др. Остаток переработки – мазут. Мазут – топливо металлургической промышленности и энергетики. Перед сжиганием мазут нагревают до 70-80оС с целью понижения его вязкости. Состав мазута – это соединения углеродов. С = 85-88%; Н2 = 10%; МДж/кг.
Твердое топливо.
Это каменный и бурый угли, антрацит, горючие сланцы, торф.
Основной метод переработки угля – коксование, заключающийся в сухой перегонке топлива путем нагрева угля без доступа воздуха при температурах 900-1100оС в коксовых печах. Получается спекшийся кокс, пористый, механически прочный, применяемый в металлургии, в основном для выплавки чугуна. Содержание С=75-85%; МДж/кг.
Отравление
Некоторые вещества, выбрасываемые в атмосферу при окислении горючего, токсичны. Отравление продуктами горения – вполне реальная угроза не только при пожаре, но и в автомобиле. Кроме того, вдыхание или другой способ попадания некоторых из них не приводит к мгновенному негативному результату, а напомнит об этом через некоторое время. К примеру, так ведут себя канцерогены.
Естественно, каждому нужно знать правила, предотвращающие негативные последствия. В первую очередь, это правила противопожарной безопасности, то есть то, что каждому ребенку рассказывают с самого раннего детства. Но, почему-то, часто бывает, что и взрослые, и дети просто забывают их.
Правила оказания первой помощи при отравлении многим тоже, скорее всего, знакомы. Но на всякий случай: самое главное, вынести отравившегося человека на свежий воздух, то есть отгородить от дальнейшего попадания токсинов в его организм. Но и нужно помнить, что существуют методы защиты от продуктов горения органов дыхания, поверхности тела. Это защитный костюм пожарных, противогазы, кислородные маски.
Защита от токсичных продуктов горения очень важна.
Условия, необходимые для возникновения и развития процесса горения
Горением называется химическая реакция окисления, сопровождающаяся выделением тепла и излучением света. Горение возникает и протекает при определенных условиях. Для пего необходимы горючее вещество, кислород и источник воспламенения.
Чтобы возникло горение, горючее вещество должно быть нагрето до определенной температуры источником воспламенения (пламенем, искрой, накаленным телом) или тепловым проявлением какого-либо другого вида энергии: химической (экзотермическая . реакция), механической (удар, сжатие, трение) и т. д.
Выделившиеся при нагревании горючего вещества пары и газы смешиваются с воздухом и окисляются, образуя горючую смесь. По мере накопления тепла в результате окисления газов и паров скорость химической реакции увеличивается, вследствие чего происходит самовоспламенение горючей смеси и появляется пламя.
С появлением пламени наступает горение, которое при бла-« гоприятных условиях продолжается до полного сгорания вещества.
В установившемся процессе горения постоянным источником воспламенения является зона горения, т. е. область, где протекает химическая реакция, выделяется тепло и излучается свет.
Для возникновения и протекания горения горючее вещество н кислород должны находиться в определенном количественном соотношении. Содержание кислорода в воздухе для большинства горючих веществ должно быть не менее 14—18%’.
Известно много различных видов очагов горения (горение свечи, мощной промышленной топки, пожар здания или сооружения и прочее). Все они значительно отличаются друг от друга и различны по характеру горючего вещества, однако основные явления, протекающие при горении и в процессе его, одинаковы.
Рассмотрим процесс горения простого светильника (свечи восковой, стеариновой и др.). Зажженная свеча горит устойчиво в нормальной среде воздуха до тех пор, пока хватает для этого содержащегося в ней горючего (воска, стеарина, парафина). Свеча потухнет вследствие нарушения одного из основных условий
процесса горения (наличия горючего вещества, кислорода и источника воспламенения), если не поддерживается достаточная температура для подогревания горючего вещества и образования паров горючего газа, но имеется топливо (воск, стеарин, парафин), и если прекратилась подача топлива и отсутствует окислитель (кислород воздуха).
При нормальном горении свечи (рис. 1) твердое ее вещество, расплавленное под воздействием пламени, впитывается фитилем и подается к основанию пламени. Здесь при более высокой температуре происходит первичное разложение горючего вещества, образуется углеводородный пар, который поступает в зону горения.
В верхней зоне горения происходит окончательное расщепление углеводородов, образуется светящаяся часть пламени собильным выделением его частиц и других продуктов горения, оставляющих дым и являющихся результатом разложения первоначальных молекул органического происхождения.
Особенности горения жидкого топлива
Основным жидким топливом, используемым в настоящее время, является мазут. В установках небольшой мощности используется также печное топливо, представляющее собой смесь технического керосина со смолами. Наибольшее практическое применение имеет метод сжигания жидкого топлива в распыленном состоянии. Распыление топлива позволяет значительно ускорить его сгорание и получить высокие тепловые напряжения объемов топочных камер вследствие увеличения площади поверхности контакта топлива с окислителем.
Температура кипения жидких топлив всегда ниже температуры их самовоспламенения, т. е. той минимальной температуры среды, начиная с которой топливо воспламеняется и затем горит без постороннего теплового источника. Эта температура выше, чем температура воспламенения, при которой топливо горит только в присутствии постороннего источника зажигания (искры, раскаленной спирали и т. п.). Из-за этого при наличии окислителя горение жидких топлив возможно лишь в парообразном состоянии. Это обстоятельство является главным для понимания механизма процесса горения жидкого топлива.
Процесс сжигания жидкого топлива включает следующие этапы: 1 — пульверизации (распыливания) при помощи форсунок; 2 — испарения и термического разложения топлива; 3 — смешения полученных продуктов с воздухом; 4 — воспламенения смеси; 5 — собственно горения.
Цель пульверизации заключается в увеличении поверхности соприкосновения жидкости с воздухом и газами. Поверхность при этом возрастает в несколько тысяч раз. За счет сильного излучения горящего факела капельки очень быстро испаряются и подвергаются термическому разложению (крекингу).
Капля жидкого топлива, попавшая в нагретый объем, температура которого выше температуры самовоспламенения, начинает частично испаряться. Пары топлива смешиваются с воздухом, и образуется паровоздушная смесь. Воспламенение происходит в тот момент, когда концентрация паров в смеси достигнет величины, превышающей ее значение на нижнем концентрационном пределе воспламенения. Горение затем поддерживается самопроизвольно за счет теплоты, получаемой каплей от сжигания горючей смеси. Начиная с момента воспламенения скорость процесса испарения, возрастает, так как температура горения горючей паро-воздушной смеси значительно превышает начальную температуру объема, куда вводится распыленное топливо.
Таким образом, горение жидкого топлива характеризуется двумя взаимосвязанными процессами: испарением топлива вследствие выделения теплоты от горящей паро-воздушной смеси и собственно горением этой смеси около поверхности капли. Гомогенное горение паровоздушной смеси — это химический процесс, а процесс испарения является по своей природе физическим. Результирующая скорость и время горения жидкого топлива будут определяться интенсивностью протекания физического или химического процесса.
При сжигании жидкого топлива факел состоит из трех фаз: 1 — жидкой; 2 — твердой (дисперсный углерод от разложения жидких углеводородов); 3 — газообразной.
Скорость горения, как и при сжигании горючих газов, зависит от условий смесеобразования, степени предварительной аэрации, степени турбулентности факела, температуры камеры сгорания и условий развития факела. Высокомолекулярные углеводородные газы, разлагаясь при высоких температурах на простые соединения, выделяют сажистый углерод, размеры частичек которого очень малы (~ 0,3 мкм). Эти частицы, раскаляясь, обеспечивают свечение пламени. Можно снизить светимость пламени тяжелых углеводородов. Для этого следует осуществить частичное предварительное смешение, т. е. подать в форсунку некоторое количество воздуха. Кислород изменяет характер разложения органических молекул: углерод выделяется не в твердом виде, а в виде окиси углерода, горящей синеватым прозрачным пламенем.
Если скорость сгорания образующихся паров значительно превышает скорость испарения топлива, то за скорость горения принимают скорость испарения и тогда τгор = τфиз + τхим.
В противном случае, когда скорость химического взаимодействия паров с окислителем значительно ниже скорости испарения топлива, интенсивность процесса сжигания будет целиком зависеть от скорости протекания химических реакций горения паро-воздушной смеси и испарение капли — наиболее длительная стадия горения жидкого топлива. Поэтому для успешного и экономичного сжигания жидкого топлива необходимо увеличивать дисперсность распыления.
Расчет горения смеси природного и доменного газов.
Исходные данные для расчета
-
Состав сухого природного и доменного газов, %
|
Газ |
CO |
CO2 |
CH4 |
C2H6 |
C3H8 |
C4H10 |
C5H12 |
H2 |
N2 |
O2 |
∑ |
|
Природный |
— |
0,5 |
85,0 |
4,0 |
2,5 |
1,5 |
1,5 |
— |
5,0 |
— |
100 |
|
Доменный |
27 |
12,7 |
0,3 |
— |
— |
— |
— |
1,4 |
58,6 |
— |
100 |
-
Коэффициент расхода воздуха: n = 1,14;
-
Содержание влаги в доменном газе: Wд.г. = 44г/м3;
-
Содержание влаги в природном газе: Wп.г. = 0г/м3 (газ сухой);
-
Теплота сгорания смеси: ;
-
Температура подогрева воздуха и газа: tВ = 600оС = 873К;
tГ = 400оС = 673К;
-
Температура уходящих продуктов сгорания (дыма): tП.Г. = 840оС = 1113К;
-
Расчет ведется на 1м3 газа.
Расчет состава природно-доменной смеси.
1. Пересчет состава сухого доменного газа на влажный.
Объемный процент водяных паров во влажном доменном газе:
 .
.
Коэффициент пересчета состава сухого доменного газа во влажный (рабочий):
 .
.
Рабочий состав доменного газа:
 ;
;
 ;
;
 ;
;
 ;
;
 .
.
Таблица 1. Состав рабочего доменного газа.
|
Газ |
СН4 |
СО2 |
H2 |
CO |
N2 |
H2O |
∑ |
|
Доменный |
0,285 |
12,039 |
1,337 |
25,596 |
55,553 |
5,19 |
100 |
2. Определение теплоты сгорания газов  .
.
Природного газа:
 .
.
Доменного газа:
 .
.
3. Расчет состава смеси природного и доменного газов.
Принимаем долю доменного газа в природно-доменной смеси (ПДС) за x, тогда доля природного газа будет равна y = (1-x). Составляем уравнение:
 ,
,
где  – исходная теплота сгорания смеси газов, МДж/м3.
– исходная теплота сгорания смеси газов, МДж/м3.
Находим, что
 .
.
у = (1-х) = 1-0,747 = 0,253.
Состав смешанного газа, %.
 ;
;









Таблица 2. Состав природно-доменной смеси.
|
CO |
CO2 |
CH4 |
C2H6 |
C3H8 |
C4H10 |
N2 |
H2 |
H2O |
∑ |
|
20,48 |
9,1196 |
21,7877 |
1,0314 |
0,7448 |
0,4641 |
41,0975 |
1,0185 |
3,8769 |
100 |
Проверка:

Погрешность: 0,004%.
4. Плотность ПДС и воздуха.
Плотность ПДС.

 .
.
Плотность воздуха.

5. Расход воздуха, необходимого для сжигания единицы топлива.
Теоретический расход воздуха (n = 1).

Действительный расход воздуха (n = 1,14).

6. Расчет количества и состава продуктов сгорания.
Объем углекислого газа в ПГ:

Объем водяных паров в ПГ:

Объем азота в ПГ:

Объем избыточного кислорода в ПГ:

Общее количество ПС:

Состав ПС:




Таблица 3. Состав продуктов сгорания.
|
Продукты сгорания |
СО2 |
Н2О |
N2 |
O2 |
∑ |
|
% |
13,1626 |
12,8199 |
71,9703 |
2,0472 |
100 |
Плотность ПС:

7. Материальный баланс процесса горения.
|
Приход, кг |
Расход, кг |
Невязка баланса, % |
|
1. Газ:
|
Продукты сгорания:
|
|
|
2. Воздух:
|
||
|
Всего: 5,728кг |
5,723кг |
8. Определение калориметрической температуры горения.
Находим начальную энтальпию продуктов сгорания 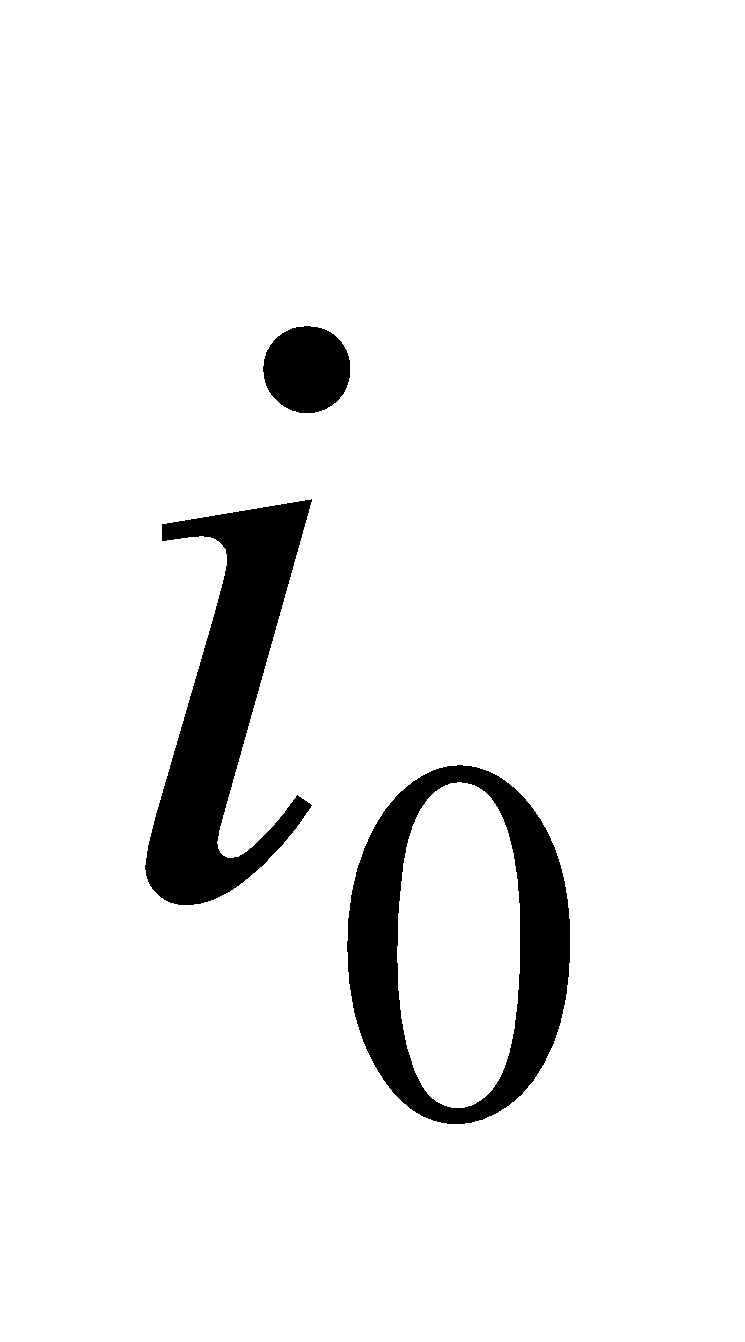 по формуле, где известно физическое тепло подогретого газа и воздуха.
по формуле, где известно физическое тепло подогретого газа и воздуха.
Физическое тепло газа:

где  – теплоемкость подогретого газа при t = 400oC, найденная по формуле:
– теплоемкость подогретого газа при t = 400oC, найденная по формуле:


где:
-
теплоемкости , и т.д., а также Св – теплоемкость подогретого воздуха берем из таблицы №4 (Расчет горения газообразного топлива. Методические указания к курсу «Теплотехника», Алматы – 1983г.);
-
теплоемкости для газов метанового ряда берем из таблицы №5 (там же).
Физическое тепло подогретого воздуха:
 .
.
Начальная энтальпия продуктов сгорания:
 .
.
По величине  , используя таблицу №7 (там же), находим приближенное значение
, используя таблицу №7 (там же), находим приближенное значение  .
.
Определяем энтальпию продуктов горения при этой температуре:





Значения  ,
,  и т.д. находим из таблицы №6 (там же).
и т.д. находим из таблицы №6 (там же).
Полученное значение  , значит,
, значит,  .
.
Находим  – энтальпию продуктов сгорания при 2000оС:
– энтальпию продуктов сгорания при 2000оС:





Получилось, что  , т.е. действительно калориметрическая температура
, т.е. действительно калориметрическая температура 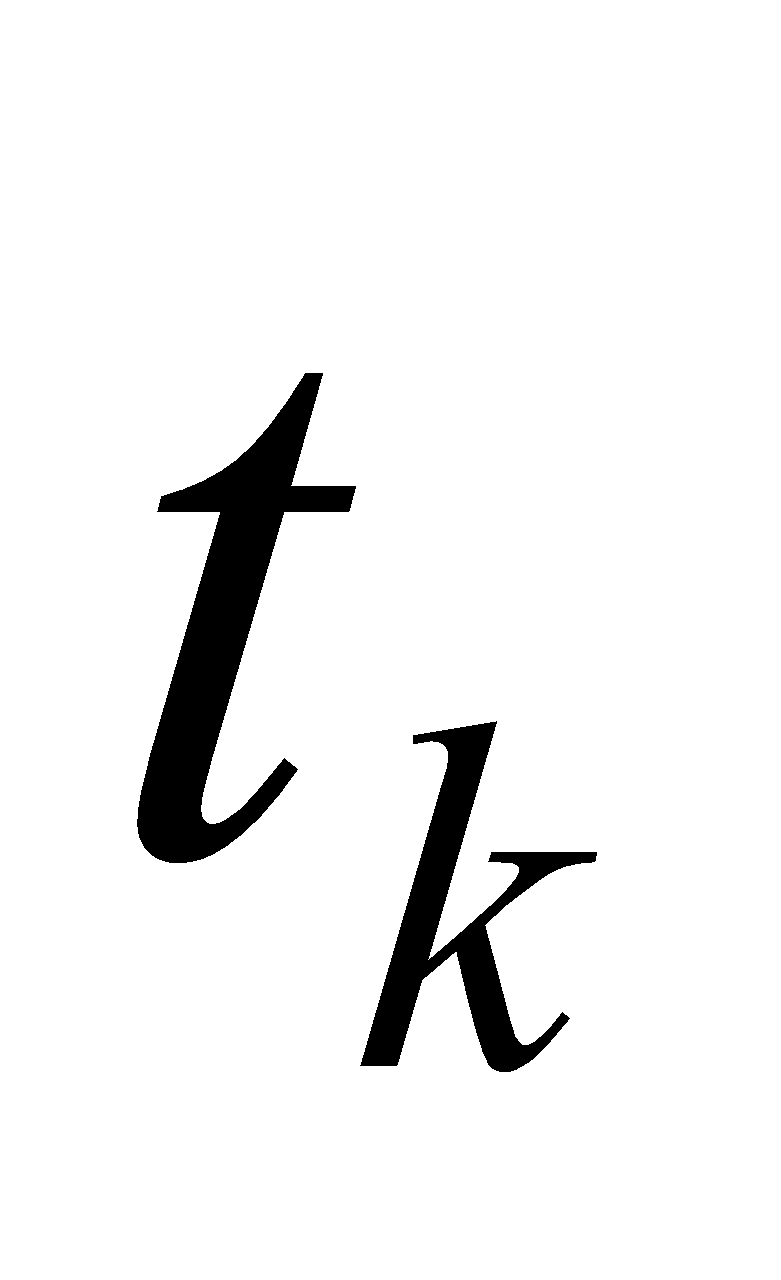 лежит в интервале
лежит в интервале  (
( ), которая равна:
), которая равна:
 .
.

Использованная литература: Расчет горения газообразного топлива. Методические указания к
курсу «Теплотехника». – Алматы.: Минвуз Казахской ССР, 1983. – 32с.
Инициация реакции
Как было отмечено, сделать это можно двумя способами:
- С помощью искры, которая должна предоставить всего 0,02 мДж теплоты. Это очень маленькое значение энергии, для сравнения скажем, что аналогичное значение для бензиновой смеси составляет 0,24 мДж, а для метановой — 0,29 мДж. С уменьшением давления энергия инициации реакции растет. Так, при 2 кПа она составляет уже 0,56 мДж. В любом случае, это очень маленькие значения, поэтому водород-кислородная смесь считается легко воспламеняющейся.
- С помощью температуры. То есть кислород-водородную смесь можно просто нагревать, и выше некоторой температуры она сама воспламенится. Когда это произойдет, зависит от давления и процентного соотношения газов. В широком интервале концентраций при атмосферном давлении реакция самовозгорания происходит при температурах выше 773-850 К, то есть выше 500-577 oC. Это достаточно высокие значения по сравнению с бензиновой смесью, которая начинает самовоспламеняться уже при температурах ниже 300 oC.
Реакции разложения
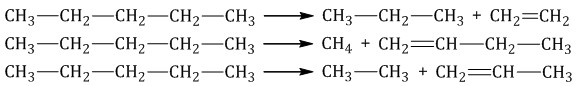
2.1. Дегидрирование и дегидроциклизация
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
| Например, при дегидрировании этана образуются этилен или ацетилен: |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
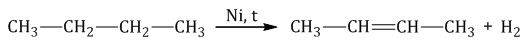
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:

Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
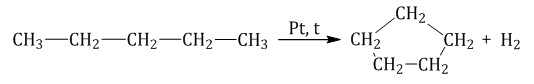
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
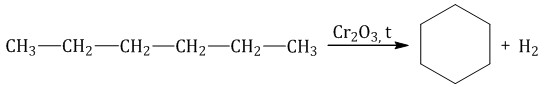
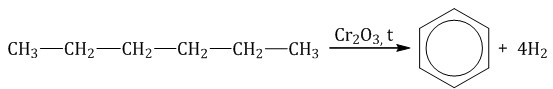
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
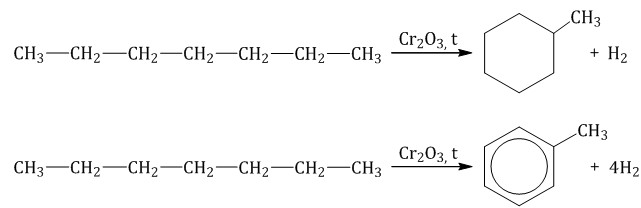
2.2. Пиролиз (дегидрирование) метана
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
|
Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды.
|
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
Услуги
- Оборудование
- Проектирование газораспределительных систем
- Строительно-монтажные, пуско-наладочные работы
Оборудование
- Оборудование в наличии
- Резервуары для хранения СУГ
- Газовые заправочные станции FAS
- Автономное газоснабжение частных домов и котеджей
- Автономное газоснабжение промышленных объектов
- Испарители
- Насосы и насосные агрегаты для СУГ
- Компрессора для СУГ
- Газозаправочные колонки
- Универсальные газовые колонки
- Наполняющее оборудование для бытовых баллонов
- Массовые расходомеры FAS
- Арматура для СУГ (краны, фильтры, клапаны, шланги и т.д.)
- Промышленные компрессоры CORKEN
- Промышленное насосное оборудование
- Газоснабжение теплиц
- Газонаполнительные станции (ГНС)
- Газгольдеры
- Фланцы
Бизнес и финансы
БанкиБогатство и благосостояниеКоррупция(Преступность)МаркетингМенеджментИнвестицииЦенные бумагиУправлениеОткрытые акционерные обществаПроектыДокументыЦенные бумаги — контрольЦенные бумаги — оценкиОблигацииДолгиВалютаНедвижимость(Аренда)ПрофессииРаботаТорговляУслугиФинансыСтрахованиеБюджетФинансовые услугиКредитыКомпанииГосударственные предприятияЭкономикаМакроэкономикаМикроэкономикаНалогиАудитМеталлургияНефтьСельское хозяйствоЭнергетикаАрхитектураИнтерьерПолы и перекрытияПроцесс строительстваСтроительные материалыТеплоизоляцияЭкстерьерОрганизация и управление производством
Что такое горение
В процессе горения температура резко повышается и выделяется большое количество тепловой энергии (теплоты). Поэтому, горение – это экзотермический процесс.
В топливе содержатся атомы химического элемента, который называется углеродом. При горении топлива каждый атом углерода объединяется в двумя атомами кислорода и выделяется энергия.
Когда горит какое-либо вещество, мы видим пламя (рис. 2).
 Рис. 2. Горение – это химическая реакция окисления топлива с образованием продуктов горения, пламенем выделением теплоты
Рис. 2. Горение – это химическая реакция окисления топлива с образованием продуктов горения, пламенем выделением теплоты
Горение – процесс сложный, потому, что во время его протекания происходит цепочка химических превращений. В основном – это реакции окисления между сгорающим топливом и кислородом;
Примечание: В окружающем воздухе содержится кислород. Кислород – это сильный окислитель.
Что нужно, чтобы горение возникло
Только лишь наличия топлива и кислорода в окружающем воздухе недостаточно, чтобы это топливо загорелось. Мы должны сначала нагреть топливо до температуры, при которой произойдет его возгорание. Для предварительного нагрева мы используем источник зажигания. Например, спички, зажигалку и т. п.
Примечание: Чтобы горение возникло, нужно сначала нагреть топливо до температуры, при которой произойдет возгорание.
Например, самостоятельно может загореться бумага, наргетая до 233 градусов Цельсия или дерево, нагретое до 300 градусов Цельсия.
Поэтому, бездумно нагревать горючие вещества опасно. Так как нагретое горючее вещество способно самостоятельно загореться, иногда со взрывом.
Температура горения некоторых веществ
- сухие дрова: от 800 до 1000 (C);
- пламя спички: от 750 до 1400 (C);
- уголь в печи или котле: от 1000 до 2300 градусов Цельсия (зависит от подачи воздуха);
- бензин: 1300 — 1400 (C);
Температура частей пламени различается
Раскаленные до высокой температуры газы, выделяющиеся при сгорании топлива, светятся. Они образуют светлый ореол около горящего топлива. Этот ореол называют пламенем. Пламя можно условно разделить на слои. Температура таких слоев пламени различается. Чем ярче пламя, чем ближе его цвет к белому цвету, тем выше его температура.
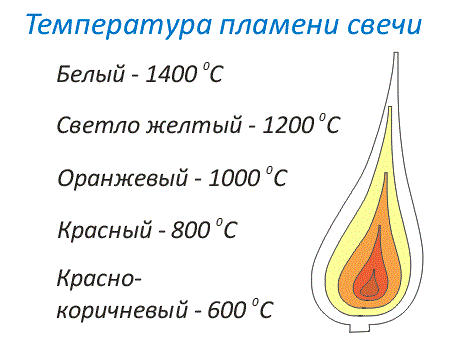 Рис. 3. Раскаленные газы, выделяющиеся при горении, светятся и, образуют пламя, которое по степени нагревания можно разделить на слои
Рис. 3. Раскаленные газы, выделяющиеся при горении, светятся и, образуют пламя, которое по степени нагревания можно разделить на слои
Удельная теплота сгорания некоторых горючих материалов
Приведена таблица удельной теплоты сгорания некоторых горючих материалов (стройматериалы, древесина, бумага, пластик, солома, резина и т. д.). Следует отметить материалы с высоким тепловыделением при сгорании. К таким материалам можно отнести: каучук различных типов, пенополистирол (пенопласт), полипропилен и полиэтилен.
| Топливо | Удельная теплота сгорания, МДж/кг |
|---|---|
| Бумага | 17,6 |
| Дерматин | 21,5 |
| Древесина (бруски влажностью 14 %) | 13,8 |
| Древесина в штабелях | 16,6 |
| Древесина дубовая | 19,9 |
| Древесина еловая | 20,3 |
| Древесина зеленая | 6,3 |
| Древесина сосновая | 20,9 |
| Капрон | 31,1 |
| Карболитовые изделия | 26,9 |
| Картон | 16,5 |
| Каучук бутадиенстирольный СКС-30АР | 43,9 |
| Каучук натуральный | 44,8 |
| Каучук синтетический | 40,2 |
| Каучук СКС | 43,9 |
| Каучук хлоропреновый | 28 |
| Линолеум поливинилхлоридный | 14,3 |
| Линолеум поливинилхлоридный двухслойный | 17,9 |
| Линолеум поливинилхлоридный на войлочной основе | 16,6 |
| Линолеум поливинилхлоридный на теплой основе | 17,6 |
| Линолеум поливинилхлоридный на тканевой основе | 20,3 |
| Линолеум резиновый (релин) | 27,2 |
| Парафин твердый | 11,2 |
| Пенопласт ПХВ-1 | 19,5 |
| Пенопласт ФС-7 | 24,4 |
| Пенопласт ФФ | 31,4 |
| Пенополистирол ПСБ-С | 41,6 |
| Пенополиуретан | 24,3 |
| Плита древесноволокнистая | 20,9 |
| Поливинилхлорид (ПВХ) | 20,7 |
| Поликарбонат | 31 |
| Полипропилен | 45,7 |
| Полистирол | 39 |
| Полиэтилен высокого давления | 47 |
| Полиэтилен низкого давления | 46,7 |
| Резина | 33,5 |
| Рубероид | 29,5 |
| Сажа канальная | 28,3 |
| Сено | 16,7 |
| Солома | 17 |
| Стекло органическое (оргстекло) | 27,7 |
| Текстолит | 20,9 |
| Толь | 16 |
| Тротил | 15 |
| Хлопок | 17,5 |
| Целлюлоза | 16,4 |
| Шерсть и шерстяные волокна | 23,1 |
- Абрютин А. А. и др. Тепловой расчет котлов. Нормативный метод.
- ГОСТ 147-2013 Топливо твердое минеральное. Определение высшей теплоты сгорания и расчет низшей теплоты сгорания.
- ГОСТ 21261-91 Нефтепродукты. Метод определения высшей теплоты сгорания и вычисление низшей теплоты сгорания.
- ГОСТ 22667-82 Газы горючие природные. Расчетный метод определения теплоты сгорания, относительной плотности и числа Воббе.
- ГОСТ 31369-2008 Газ природный. Вычисление теплоты сгорания, плотности, относительной плотности и числа Воббе на основе компонентного состава.
- Земский Г. Т. Огнеопасные свойства неорганических и органических материалов: справочник М.: ВНИИПО, 2016 — 970 с.